キイトルーダ点滴静注100mg
医療用
医療用医薬品:
医師の処方により使用する医薬品
医師の処方により使用する医薬品
- 収載区分
- 銘柄別収載
- 先発・後発情報
- 先発品(後発品なし)
- オーソライズド
ジェネリック - -
- 一般名
- ペムブロリズマブ(遺伝子組換え)注射液
- 英名(商品名)
- Keytruda
- 規格
- 100mg4mL1瓶
- 薬価
- 214,498.00
- メーカー名
- MSD
- 規制区分
- 劇薬
- 長期投与制限
- -
- 標榜薬効
- 抗悪性腫瘍薬〔ヒト型抗ヒトPD−1モノクローナル抗体〕
- 色
- -
- 識別コード
- -
- [@: メーカーロゴ]
- 添付文書
-
PDF 2025年7月改訂(第25版)
- 告示日
- 2017年2月14日
- 経過措置期限
- -
- 医薬品マスタに反映
- 2017年3月版
- 医薬品マスタ削除予定
- -
- 運転注意
- 情報なし(使用の適否を判断するものではありません)
- ドーピング
- 禁止物質なし(使用の適否を判断するものではありません)
- CP換算
- -
- 長期収載品選定療養
- -
[識別コードの表記 @: メーカーロゴ]
効能効果
1). 悪性黒色腫。
2). 切除不能な進行・再発の非小細胞肺癌。
3). 非小細胞肺癌における術前・術後補助療法。
4). 再発又は難治性の古典的ホジキンリンパ腫。
5). 根治切除不能な尿路上皮癌。
6). がん化学療法後に増悪した進行・再発のMSI-Highを有する固形癌(標準的な治療が困難な場合に限る)(MSI-High:高頻度マイクロサテライト不安定性)。
7). 根治切除不能又は転移性の腎細胞癌。
8). 腎細胞癌における術後補助療法。
9). 再発又は遠隔転移を有する頭頸部癌。
10). 根治切除不能な進行・再発の食道癌。
11). 治癒切除不能な進行・再発のMSI-Highを有する結腸癌、治癒切除不能な進行・再発のMSI-Highを有する直腸癌(MSI-High:高頻度マイクロサテライト不安定性)。
12). PD-L1陽性のホルモン受容体陰性かつHER2陰性の手術不能又は再発乳癌。
13). ホルモン受容体陰性かつHER2陰性で再発高リスク乳癌の術前・術後薬物療法。
14). 進行・再発の子宮体癌。
15). がん化学療法後に増悪したTMB-Highを有する進行・再発の固形癌(標準的な治療が困難な場合に限る)(TMB-High:高い腫瘍遺伝子変異量)。
16). 進行又は再発の子宮頸癌。
17). 局所進行子宮頸癌。
18). 再発又は難治性の原発性縦隔大細胞型B細胞リンパ腫。
19). 治癒切除不能な進行・再発の胃癌。
20). 治癒切除不能な胆道癌。
21). 切除不能な進行・再発の悪性胸膜中皮腫。
(効能又は効果に関連する注意)
5.1. 〈悪性黒色腫〉臨床試験に組み入れられた患者の病期等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと〔17.1.4、17.1.5参照〕。
5.2. 〈切除不能な進行・再発の非小細胞肺癌〉本剤を単独で投与する場合には、PD-L1の発現が確認された患者に投与すること(PD-L1を発現した腫瘍細胞が占める割合(TPS)について、「17.臨床成績」の項の内容を熟知し、十分な経験を有する病理医又は検査施設において、承認された体外診断用医薬品又は医療機器を用いること)。なお、承認された体外診断用医薬品又は医療機器に関する情報については、次のウェブサイトから入手可能である:
https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html。
〔17.1.8-17.1.10参照〕。
5.3. 〈切除不能な進行・再発の非小細胞肺癌〉臨床試験に組み入れられた患者のEGFR遺伝子変異又はALK融合遺伝子の有無等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと〔17.1.6、17.1.8-17.1.10参照〕。
5.4. 〈非小細胞肺癌における術前・術後補助療法〉臨床試験に組み入れられた患者の病期等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと〔17.1.11参照〕。
5.5. 〈再発又は難治性の古典的ホジキンリンパ腫〉臨床試験に組み入れられた患者の前治療歴等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと〔17.1.12、17.1.13参照〕。
5.6. 〈根治切除不能な尿路上皮癌〉本剤の手術の補助療法としての有効性及び安全性は確立していない。
5.7. 〈根治切除不能な尿路上皮癌〉白金系抗悪性腫瘍剤を含む化学療法の適応とならない化学療法未治療尿路上皮癌患者への本剤単独投与については、他の治療の実施についても慎重に検討すること。
5.8. 〈がん化学療法後に増悪した進行・再発のMSI-Highを有する固形癌(標準的な治療が困難な場合に限る)〉十分な経験を有する病理医又は検査施設における検査により、MSI-Highが確認された進行・再発の固形癌患者に投与すること(検査にあたっては、関連学会のガイドライン等の最新の情報を参考に、先行の化学療法等によるMSI検査結果への影響及び検査に用いる検体の採取時期について確認し、承認された体外診断用医薬品又は医療機器を用いること)。なお、承認された体外診断用医薬品又は医療機器に関する情報については、次のウェブサイトから入手可能である:
https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html。
5.9. 〈がん化学療法後に増悪した進行・再発のMSI-Highを有する固形癌(標準的な治療が困難な場合に限る)〉MSI-Highを有する結腸・直腸癌以外の固形癌の場合、本剤の一次治療における有効性及び安全性は確立していない。また、MSI-Highを有する結腸・直腸癌以外の固形癌の場合、二次治療において標準的な治療が可能な場合にはこれらの治療を優先すること。
5.10. 〈がん化学療法後に増悪した進行・再発のMSI-Highを有する固形癌(標準的な治療が困難な場合に限る)〉本剤の手術の補助療法における有効性及び安全性は確立していない。
5.11. 〈がん化学療法後に増悪した進行・再発のMSI-Highを有する固形癌(標準的な治療が困難な場合に限る)〉臨床試験に組み入れられた患者のがん種等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、本剤以外の治療の実施についても慎重に検討し、適応患者の選択を行うこと〔17.1.17、17.1.18参照〕。
5.12. 〈腎細胞癌における術後補助療法〉臨床試験に組み入れられた患者の病期等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと〔17.1.21参照〕。
5.13. 〈再発又は遠隔転移を有する頭頸部癌〉本剤の術後補助療法における有効性及び安全性は確立していない。
5.14. 〈再発又は遠隔転移を有する頭頸部癌〉本剤単独投与の延命効果は、PD-L1発現率(CPS)により異なる傾向が示唆されているので、CPSについて、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと〔17.1.22参照〕。
5.15. 〈再発又は遠隔転移を有する頭頸部癌〉「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと〔17.1.22参照〕。
5.16. 〈根治切除不能な進行・再発の食道癌〉がん化学療法後に増悪したPD-L1陽性の根治切除不能な進行・再発の食道扁平上皮癌に対して、本剤を単独で投与する場合には、PD-L1発現率(CPS)について、「17.臨床成績」の項の内容を熟知し、十分な経験を有する病理医又は検査施設における検査により、PD-L1の発現が確認された患者に投与すること(検査にあたっては、承認された体外診断用医薬品又は医療機器を用いること)。なお、承認された体外診断用医薬品又は医療機器に関する情報については、次のウェブサイトから入手可能である:
https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html。
〔17.1.24参照〕。
5.17. 〈根治切除不能な進行・再発の食道癌〉本剤の手術の補助療法における有効性及び安全性は確立していない。
5.18. 〈治癒切除不能な進行・再発のMSI-Highを有する結腸・直腸癌〉十分な経験を有する病理医又は検査施設における検査により、MSI-Highが確認された患者に投与すること(検査にあたっては、承認された体外診断用医薬品又は医療機器を用いること)。なお、承認された体外診断用医薬品又は医療機器に関する情報については、次のウェブサイトから入手可能である:
https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html。
5.19. 〈治癒切除不能な進行・再発のMSI-Highを有する結腸・直腸癌〉本剤の術後補助療法における有効性及び安全性は確立していない。
5.20. 〈PD-L1陽性のホルモン受容体陰性かつHER2陰性の手術不能又は再発乳癌〉PD-L1発現率(CPS)について、「17.臨床成績」の項の内容を熟知し、十分な経験を有する病理医又は検査施設における検査により、PD-L1の発現が確認された患者に投与すること(検査にあたっては、承認された体外診断用医薬品又は医療機器を用いること)。なお、承認された体外診断用医薬品又は医療機器に関する情報については、次のウェブサイトから入手可能である:
https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html。
〔17.1.26参照〕。
5.21. 〈ホルモン受容体陰性かつHER2陰性で再発高リスクの乳癌における術前・術後薬物療法〉臨床試験に組み入れられた患者の再発高リスクの定義等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと〔17.1.27参照〕。
5.22. 〈進行・再発の子宮体癌〉本剤の術後補助療法における有効性及び安全性は確立していない。
5.23. 〈進行・再発の子宮体癌〉臨床試験に組み入れられた患者の病期等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと〔17.1.28、17.1.29参照〕。
5.24. 〈がん化学療法後に増悪したTMB-Highを有する進行・再発の固形癌(標準的な治療が困難な場合に限る)〉十分な経験を有する病理医又は検査施設における検査により、TMB-Highが確認された患者に投与すること(検査にあたっては、関連学会のガイドライン等の最新の情報を参考に、先行の化学療法等によるTMB検査結果への影響及び検査に用いる検体の採取時期について確認し、承認された体外診断用医薬品又は医療機器を用いること)。なお、承認された体外診断用医薬品又は医療機器に関する情報については、次のウェブサイトから入手可能である:
https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html。
5.25. 〈がん化学療法後に増悪したTMB-Highを有する進行・再発の固形癌(標準的な治療が困難な場合に限る)〉本剤の一次治療における有効性及び安全性は確立していない。また、がん化学療法後に増悪したTMB-Highを有する進行・再発の固形癌の場合、二次治療において標準的な治療が可能な場合にはこれらの治療を優先すること。
5.26. 〈がん化学療法後に増悪したTMB-Highを有する進行・再発の固形癌(標準的な治療が困難な場合に限る)〉本剤の手術の補助療法における有効性及び安全性は確立していない。
5.27. 〈がん化学療法後に増悪したTMB-Highを有する進行・再発の固形癌(標準的な治療が困難な場合に限る)〉臨床試験に組み入れられた患者のがん種等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、本剤以外の治療の実施についても慎重に検討し、適応患者の選択を行うこと〔17.1.30参照〕。
5.28. 〈進行又は再発の子宮頸癌〉本剤の有効性は、PD-L1発現率(CPS)により異なる傾向が示唆されているので、CPSについて、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと〔17.1.31参照〕。
5.29. 〈進行又は再発の子宮頸癌〉本剤の術後補助療法における有効性及び安全性は確立していない。
5.30. 〈局所進行子宮頸癌〉臨床試験に組み入れられた患者の病期等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと〔17.1.32参照〕。
5.31. 〈局所進行子宮頸癌〉本剤の術後補助療法における有効性及び安全性は確立していない。
5.32. 〈再発又は難治性の原発性縦隔大細胞型B細胞リンパ腫〉臨床試験に組み入れられた患者の前治療歴等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと〔17.1.33、17.1.34参照〕。
5.33. 〈治癒切除不能な進行・再発の胃癌〉本剤の術後補助療法における有効性及び安全性は確立していない。
5.34. 〈治癒切除不能な進行・再発の胃癌〉本剤の有効性は、PD-L1発現率(CPS)により異なる傾向が示唆されている。
5.34.1. 〈治癒切除不能な進行・再発の胃癌〉HER2陰性の治癒切除不能な進行・再発の胃癌に対して本剤を投与する場合には、本剤の有効性は、PD-L1発現率(CPS)により異なる傾向が示唆されているので、CPSについて、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと〔17.1.35参照〕。
5.34.2. 〈治癒切除不能な進行・再発の胃癌〉HER2陽性の治癒切除不能な進行・再発の胃癌に対して本剤を投与する場合には、本剤の有効性は、PD-L1発現率(CPS)により異なる傾向が示唆されているので、CPSについて、「17.臨床成績」の項の内容を熟知し、十分な経験を有する病理医又は検査施設における検査により、PD-L1の発現が確認された患者に投与すること(検査にあたっては、承認された体外診断用医薬品又は医療機器を用いること)。なお、承認された体外診断用医薬品又は医療機器に関する情報については、次のウェブサイトから入手可能である:
https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html。
〔17.1.36参照〕。
5.35. 〈治癒切除不能な胆道癌〉本剤の術後補助療法における有効性及び安全性は確立していない。
5.36. 〈切除不能な進行・再発の悪性胸膜中皮腫〉本剤の手術の補助療法における有効性及び安全性は確立していない。
用法用量
〈悪性黒色腫〉
通常、成人には、ペムブロリズマブ(遺伝子組換え)として、1回200mgを3週間間隔又は1回400mgを6週間間隔で30分間かけて点滴静注する。ただし、悪性黒色腫で術後補助療法の場合は、投与期間は12ヵ月間までとする。
〈切除不能な進行・再発の非小細胞肺癌、再発又は難治性の古典的ホジキンリンパ腫、根治切除不能な尿路上皮癌、がん化学療法後に増悪した進行・再発のMSI-Highを有する固形癌(標準的な治療が困難な場合に限る)、再発又は遠隔転移を有する頭頸部癌、治癒切除不能な進行・再発のMSI-Highを有する結腸・直腸癌、がん化学療法後に増悪したTMB-Highを有する進行・再発の固形癌(標準的な治療が困難な場合に限る)、再発又は難治性の原発性縦隔大細胞型B細胞リンパ腫〉
通常、成人には、ペムブロリズマブ(遺伝子組換え)として、1回200mgを3週間間隔又は1回400mgを6週間間隔で30分間かけて点滴静注する。
〈非小細胞肺癌における術前・術後補助療法〉
術前補助療法では、他の抗悪性腫瘍剤との併用において、通常、成人には、ペムブロリズマブ(遺伝子組換え)として、1回200mgを3週間間隔又は1回400mgを6週間間隔で30分間かけて点滴静注する。その後、術後補助療法では、ペムブロリズマブ(遺伝子組換え)として、1回200mgを3週間間隔又は1回400mgを6週間間隔で30分間かけて点滴静注する。投与回数は、3週間間隔投与の場合、術前補助療法は4回まで、術後補助療法は13回まで、6週間間隔投与の場合、術前補助療法は2回まで、術後補助療法は7回までとする。
〈根治切除不能又は転移性の腎細胞癌、PD-L1陽性のホルモン受容体陰性かつHER2陰性の手術不能又は再発乳癌、進行・再発の子宮体癌、進行又は再発の子宮頸癌、治癒切除不能な進行・再発の胃癌、切除不能な進行・再発の悪性胸膜中皮腫〉
他の抗悪性腫瘍剤との併用において、通常、成人には、ペムブロリズマブ(遺伝子組換え)として、1回200mgを3週間間隔又は1回400mgを6週間間隔で30分間かけて点滴静注する。
〈腎細胞癌における術後補助療法〉
通常、成人には、ペムブロリズマブ(遺伝子組換え)として、1回200mgを3週間間隔又は1回400mgを6週間間隔で30分間かけて点滴静注する。腎細胞癌における術後補助療法の場合は、投与期間は12ヵ月間までとする。
〈根治切除不能な進行・再発の食道癌〉
フルオロウラシル及びシスプラチンとの併用において、通常、成人には、ペムブロリズマブ(遺伝子組換え)として、1回200mgを3週間間隔又は1回400mgを6週間間隔で30分間かけて点滴静注する。がん化学療法後に増悪したPD-L1陽性の根治切除不能な進行・再発の食道扁平上皮癌に対しては、本剤を単独投与することもできる。
〈ホルモン受容体陰性かつHER2陰性で再発高リスクの乳癌における術前・術後薬物療法〉
通常、成人には、ペムブロリズマブ(遺伝子組換え)として、1回200mgを3週間間隔又は1回400mgを6週間間隔で30分間かけて点滴静注する。投与回数は、3週間間隔投与の場合、術前薬物療法は8回まで、術後薬物療法は9回まで、6週間間隔投与の場合、術前薬物療法は4回まで、術後薬物療法は5回までとする。
〈局所進行子宮頸癌〉
シスプラチンを用いた同時化学放射線療法との併用において、通常、成人には、ペムブロリズマブ(遺伝子組換え)として、1回200mgを3週間間隔又は1回400mgを6週間間隔で30分間かけて点滴静注する。局所進行子宮頸癌の場合は、投与期間は24ヵ月間までとする。
〈治癒切除不能な胆道癌〉
ゲムシタビン塩酸塩及びシスプラチンとの併用において、通常、成人には、ペムブロリズマブ(遺伝子組換え)として、1回200mgを3週間間隔又は1回400mgを6週間間隔で30分間かけて点滴静注する。
(用法及び用量に関連する注意)
7.1. 〈切除不能な進行・再発の非小細胞肺癌〉本剤を他の抗悪性腫瘍剤と併用する場合、併用する他の抗悪性腫瘍剤は「17.臨床成績」の項の内容を熟知し、国内外の最新のガイドライン等を参考にした上で、選択すること〔17.1.6、17.1.7参照〕。
7.2. 〈非小細胞肺癌における術前・術後補助療法〉併用する他の抗悪性腫瘍剤は「17.臨床成績」の項の内容を熟知し、国内外の最新のガイドライン等を参考にした上で、選択すること〔17.1.11参照〕。
7.3. 〈根治切除不能な尿路上皮癌〉エンホルツマブ ベドチン<遺伝子組換え>以外の抗悪性腫瘍剤との併用について、有効性及び安全性は確立していない。
7.4. 〈根治切除不能な尿路上皮癌〉白金系抗悪性腫瘍剤を含む化学療法の適応となる化学療法未治療の尿路上皮癌患者に対する本剤単独投与の有効性及び安全性は確立していない。
7.5. 〈再発又は遠隔転移を有する頭頸部癌〉本剤の用法及び用量は「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、選択すること(また、本剤を他の抗悪性腫瘍剤と併用する場合、併用する他の抗悪性腫瘍剤は「17.臨床成績」の項の内容を熟知し、国内外の最新のガイドライン等を参考にした上で、選択すること)〔17.1.22参照〕。
7.6. 〈根治切除不能又は転移性の腎細胞癌〉併用する他の抗悪性腫瘍剤は「17.臨床成績」の項の内容を熟知し、国内外の最新のガイドライン等を参考にした上で、選択すること〔17.1.19、17.1.20参照〕。
7.7. 〈PD-L1陽性のホルモン受容体陰性かつHER2陰性の手術不能又は再発乳癌〉併用する他の抗悪性腫瘍剤は「17.臨床成績」の項の内容を熟知し、国内外の最新のガイドライン等を参考にした上で、選択すること〔17.1.26参照〕。
7.8. 〈ホルモン受容体陰性かつHER2陰性で再発高リスクの乳癌における術前・術後薬物療法〉本剤の用法は「17.臨床成績」の項の内容を熟知し選択すること(また、併用する他の抗悪性腫瘍剤は「17.臨床成績」の項の内容を熟知し、国内外の最新のガイドライン等を参考にした上で、選択すること)〔17.1.27参照〕。
7.9. 〈進行・再発の子宮体癌〉併用する他の抗悪性腫瘍剤は「17.臨床成績」の項の内容を熟知し選択すること〔17.1.28、17.1.29参照〕。
7.10. 〈進行・再発の子宮体癌〉本剤とレンバチニブとの併用について、進行・再発の子宮体癌の一次治療における有効性及び安全性は確立していない。
7.11. 〈進行又は再発の子宮頸癌〉併用する他の抗悪性腫瘍剤は「17.臨床成績」の項の内容を熟知し選択すること〔17.1.31参照〕。
7.12. 〈治癒切除不能な進行・再発の胃癌〉併用する他の抗悪性腫瘍剤は「17.臨床成績」の項の内容を熟知し、国内外の最新のガイドライン等を参考にした上で、選択すること〔17.1.35、17.1.36参照〕。
7.13. 〈切除不能な進行・再発の悪性胸膜中皮腫〉併用する他の抗悪性腫瘍剤は「17.臨床成績」の項の内容を熟知し選択すること〔17.1.38、17.1.39参照〕。
7.14. 〈切除不能な進行・再発の悪性胸膜中皮腫〉カルボプラチン及びペメトレキセドナトリウムと併用する場合、通常、成人には、3週間間隔で、カルボプラチンは1回AUC5~6mg・min/mL相当量を30分以上かけて点滴静注し、ペメトレキセドナトリウムは1回500mg/㎡を10分間かけて点滴静注すること(なお、患者の状態により適宜減量すること)。
7.15. 〈悪性黒色腫、再発又は難治性の古典的ホジキンリンパ腫、がん化学療法後に増悪した進行・再発のMSI-Highを有する固形癌(標準的な治療が困難な場合に限る)、腎細胞癌における術後補助療法、治癒切除不能な進行・再発のMSI-Highを有する結腸・直腸癌、がん化学療法後に増悪したTMB-Highを有する進行・再発の固形癌(標準的な治療が困難な場合に限る)、再発又は難治性の原発性縦隔大細胞型B細胞リンパ腫〉他の抗悪性腫瘍剤との併用について、有効性及び安全性は確立していない。
7.16. 〈効能共通〉本剤投与により副作用が発現した場合には、次を参考に、本剤を休薬又は中止すること。
1). 〈効能共通〉間質性肺疾患:
①. 〈効能共通〉Grade2の間質性肺疾患の場合:Grade1以下に回復するまで、本剤を休薬する(12週間を超える休薬後もGrade1以下まで回復しない場合には、本剤を中止する)。
②. 〈効能共通〉Grade3以上の間質性肺疾患又は再発性のGrade2の間質性肺疾患の場合:本剤を中止する。
2). 〈効能共通〉大腸炎/下痢:
①. 〈効能共通〉Grade2の大腸炎/Grade2の下痢又はGrade3の大腸炎/Grade3の下痢の場合:Grade1以下に回復するまで、本剤を休薬する(12週間を超える休薬後もGrade1以下まで回復しない場合には、本剤を中止する)。
②. 〈効能共通〉Grade4の大腸炎/Grade4の下痢又は再発性のGrade3の大腸炎/再発性のGrade3の下痢の場合:本剤を中止する。
3). 〈効能共通〉肝機能障害:
①. 〈効能共通〉ASTがULNの3~5倍若しくはALTがULNの3~5倍又は総BilがULNの1.5~3倍に増加した場合:Grade1以下に回復するまで、本剤を休薬する(12週間を超える休薬後もGrade1以下まで回復しない場合には、本剤を中止する)。
②. 〈効能共通〉腎細胞癌患者でのアキシチニブとの併用における初回発現時では、ASTがULN3倍以上10倍未満で総BilがULN2倍未満<初回発現時>又はALTがULN3倍以上10倍未満で総BilがULN2倍未満<初回発現時>の場合:Grade1以下に回復するまで、本剤を休薬する(12週間を超える休薬後もGrade1以下まで回復しない場合には、本剤を中止する)。
③. 〈効能共通〉ASTがULNの5倍超若しくはALTがULNの5倍超又は総BilがULNの3倍超に増加した場合:本剤を中止する。
④. 〈効能共通〉肝転移がありASTが治療開始時にGrade2又は肝転移がありALTが治療開始時にGrade2で、かつASTのベースラインから50%以上の増加が1週間以上持続又はALTのベースラインから50%以上の増加が1週間以上持続する場合:本剤を中止する。
⑤. 〈効能共通〉腎細胞癌患者でのアキシチニブとの併用における初回発現時では、ASTがULNの10倍以上<初回発現時>若しくはALTがULNの10倍以上<初回発現時>、又はASTがULNの3倍超かつ総BilがULNの2倍以上<初回発現時>若しくはALTがULNの3倍超かつ総BilがULNの2倍以上<初回発現時>に増加した場合:本剤を中止する。
(ULN:基準値上限、Bil:ビリルビン)。
4). 〈効能共通〉腎機能障害:
①. 〈効能共通〉Grade2の腎機能障害の場合:Grade1以下に回復するまで、本剤を休薬する(12週間を超える休薬後もGrade1以下まで回復しない場合には、本剤を中止する)。
②. 〈効能共通〉Grade3以上の腎機能障害の場合:本剤を中止する。
5). 〈効能共通〉内分泌障害:①Grade2以上の下垂体炎、②症候性の内分泌障害<甲状腺機能低下症を除く>、③Grade3以上の甲状腺機能障害、④Grade3以上の高血糖、⑤1型糖尿病:Grade1以下に回復するまで、本剤を休薬する(12週間を超える休薬後もGrade1以下まで回復しない場合には、本剤の中止を検討する)。
6). 〈効能共通〉Infusion reaction:
①. 〈効能共通〉Grade2のInfusion reactionの場合:本剤の投与を直ちに中止する(1時間以内に回復する場合には、投与速度を50%減速して再開する)。
②. 〈効能共通〉Grade3以上のInfusion reactionの場合又は再発性のGrade2のInfusion reactionの場合:本剤を直ちに中止し、再投与しない。
7). 〈効能共通〉前記以外の副作用:①Grade4<再発又は難治性CHL・PMBCL患者における血液毒性除く>又は再発性のGrade3の副作用、②Grade3以上の心筋炎、Grade3以上の脳炎、Grade3以上のギラン・バレー症候群、③副作用の処置としてのACH剤をPSL換算で10mg/日相当量以下に12週間以内に減量できない場合、④12週間を超える休薬後もGrade1以下まで回復しない場合:本剤を中止する(CHL:古典的ホジキンリンパ腫、PMBCL:原発性縦隔大細胞型B細胞リンパ腫、ACH剤:副腎皮質ホルモン剤、PSL:プレドニゾロン)。再発又は難治性の古典的ホジキンリンパ腫、再発又は難治性の原発性縦隔大細胞型B細胞リンパ腫患者においてGrade4の血液毒性が発現した場合は、Grade1以下に回復するまで本剤を休薬する。
GradeはNCI-CTCAE(Common Terminology Criteria for Adverse Events)v4.0に準じる。
改訂情報
2025年8月13日 DSU No.338 【重要】
【11.1重大な副作用】(追記)
血管炎:
大型血管炎、中型血管炎、小型血管炎[抗好中球細胞質抗体(ANCA)関連血管炎、IgA血管炎を含む]があらわれることがある。
2025年7月30日 使用上の注意改訂情報 令和7年7月30日指示分
【11. 副作用-11.1 重大な副作用】(新設)
血管炎
大型血管炎、中型血管炎、小型血管炎[抗好中球細胞質抗体(ANCA)関連血管炎、IgA 血管炎を含む]があらわれることがある。
2025年6月3日 DSU No.336 【その他】
【5.効能又は効果に関連する注意】(削除)
〈治癒切除不能な進行・再発の胃癌〉
HER2陰性の患者に投与すること。
【5.効能又は効果に関連する注意】(一部改訂)
HER2陰性の治癒切除不能な進行・再発の胃癌に対して本剤を投与する場合には、CPSについて、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。
【5.効能又は効果に関連する注意】(追記)
HER2陽性の治癒切除不能な進行・再発の胃癌に対して本剤を投与する場合には、CPSについて、「17.臨床成績」の項の内容を熟知し、十分な経験を有する病理医又は検査施設における検査により、PD-L1の発現が確認された患者に投与すること。検査にあたっては、承認された体外診断用医薬品又は医療機器を用いること。なお、承認された体外診断用医薬品又は医療機器に関する情報については、以下のウェブサイトから入手可能である:
https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html
【5.効能又は効果に関連する注意】(追記)
〈切除不能な進行・再発の悪性胸膜中皮腫〉
本剤の手術の補助療法における有効性及び安全性は確立していない。
【6.用法及び用量】(一部改訂)
〈根治切除不能又は転移性の腎細胞癌、PD-L1陽性のホルモン受容体陰性かつHER2陰性の手術不能又は再発乳癌、進行・再発の子宮体癌、進行又は再発の子宮頸癌、治癒切除不能な進行・再発の胃癌、切除不能な進行・再発の悪性胸膜中皮腫〉
他の抗悪性腫瘍剤との併用において、通常、成人には、ペムブロリズマブ(遺伝子組換え)として、1回200mgを3週間間隔又は1回400mgを6週間間隔で30分間かけて点滴静注する。
【7.用法及び用量に関連する注意】(追記)
〈切除不能な進行・再発の悪性胸膜中皮腫〉
併用する他の抗悪性腫瘍剤は「17.臨床成績」の項の内容を熟知し選択すること。
【7.用法及び用量に関連する注意】(追記)
カルボプラチン及びペメトレキセドナトリウムと併用する場合、通常、成人には、3週間間隔で、カルボプラチンは1回AUC5~6mg・min/mL相当量を30分以上かけて点滴静注し、ペメトレキセドナトリウムは1回500mg/㎡を10分間かけて点滴静注すること。なお、患者の状態により適宜減量すること。
【14.適用上の注意】(一部改訂)
[薬剤調製時の注意]
本剤は保存料を含まないため無菌的に調製すること。希釈液をすぐに使用せず保管する場合には、希釈から投与終了までの時間を、25℃以下で12時間以内又は2~8℃で7日以内とすること。希釈液を冷所保存した場合には、投与前に点滴バッグを常温に戻すこと。
2025年2月12日 DSU No.333 【重要】
【11.1重大な副作用】(一部改訂)
膵炎、膵外分泌機能不全
2025年2月12日 DSU No.333 【その他】
【5.効能又は効果に関連する注意】(削除)
〈がん化学療法後に増悪した切除不能な進行・再発の子宮体癌〉
本剤の一次治療における有効性及び安全性は確立していない。
【5.効能又は効果に関連する注意】(一部改訂)
〈進行・再発の子宮体癌〉
本剤の術後補助療法における有効性及び安全性は確立していない。
【5.効能又は効果に関連する注意】(一部改訂)
臨床試験に組み入れられた患者の病期等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。
【6.用法及び用量】(一部改訂)
〈根治切除不能又は転移性の腎細胞癌、PD-L1陽性のホルモン受容体陰性かつHER2陰性の手術不能又は再発乳癌、進行・再発の子宮体癌、進行又は再発の子宮頸癌、治癒切除不能な進行・再発の胃癌〉
他の抗悪性腫瘍剤との併用において、通常、成人には、ペムブロリズマブ(遺伝子組換え)として、1回200mgを3週間間隔又は1回400mgを6週間間隔で30分間かけて点滴静注する。
【6.用法及び用量】(削除)
〈がん化学療法後に増悪した切除不能な進行・再発の子宮体癌〉
レンバチニブメシル酸塩との併用において、通常、成人には、ペムブロリズマブ(遺伝子組換え)として、1回200mgを3週間間隔又は1回400mgを6週間間隔で30分間かけて点滴静注する。
【7.用法及び用量に関連する注意】(追記)
〈進行・再発の子宮体癌〉
併用する他の抗悪性腫瘍剤は「17.臨床成績」の項の内容を熟知し選択すること。
【7.用法及び用量に関連する注意】(追記)
本剤とレンバチニブとの併用について、一次治療における有効性及び安全性は確立していない。
【9.4生殖能を有する者】(一部改訂)
妊娠する可能性のある女性には、本剤投与中及び最終投与後4ヵ月間において避妊する必要性及び適切な避妊法について説明すること。
【11.2その他の副作用】(一部改訂)
2025年1月29日 使用上の注意改訂情報 令和7年1月29日指示分
【11. 副作用-11.1 重大な副作用】(一部改訂)
膵炎、膵外分泌機能不全
2025年1月6日 DSU No.332 【その他】
【5.効能又は効果に関連する注意】(追記)
〈局所進行子宮頸癌〉
臨床試験に組み入れられた患者の病期等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。
【5.効能又は効果に関連する注意】(追記)
本剤の術後補助療法における有効性及び安全性は確立していない。
【6.用法及び用量】(追記)
〈局所進行子宮頸癌〉
シスプラチンを用いた同時化学放射線療法との併用において、通常、成人には、ペムブロリズマブ(遺伝子組換え)として、1回200mgを3週間間隔又は1回400mgを6週間間隔で30分間かけて点滴静注する。投与期間は24ヵ月間までとする。
【11.2その他の副作用】(一部改訂)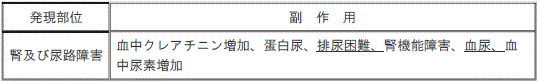
類似した薬効の薬
よく一緒に見られている薬
医師の処方により使用する医薬品。
特定薬剤管理指導加算等の算定対象となる薬剤。



 で医薬品を比較する
で医薬品を比較する
