オムジャラ錠200mg
医療用
医療用医薬品:
医師の処方により使用する医薬品
医師の処方により使用する医薬品
- 収載区分
- 銘柄別収載
- 先発・後発情報
- 先発品(後発品なし)
- オーソライズド
ジェネリック - -
- 一般名
- モメロチニブ塩酸塩水和物錠
- 英名(商品名)
- Omjjara
- 規格
- 200mg1錠
- 薬価
- 42,428.00
- メーカー名
- GSK
- 規制区分
- 劇薬
- 長期投与制限
- 14日(2025年08月末まで)
- 標榜薬効
- 抗悪性腫瘍薬〔ヤヌスキナーゼ(JAK)/アクチビンA受容体1型(ACVR1)阻害薬〕
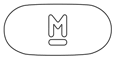
- 色
- 褐
- 識別コード
- (本体)M (本体)200
- [@: メーカーロゴ]
- 添付文書
-
PDF 2024年8月改訂(第2版)
- 告示日
- 2024年8月14日
- 経過措置期限
- -
- 医薬品マスタに反映
- 2024年9月版
- 医薬品マスタ削除予定
- -
- 運転注意
- 情報なし(使用の適否を判断するものではありません)
- ドーピング
-
禁止物質あり(使用の適否を判断するものではありません)
競技会区分:常に禁止(競技会検査及び競技会外検査)
セクション:S2. ペプチドホルモン、成長因子並びにそれらの関連物質及び擬似物質
- CP換算
- -
- 長期収載品選定療養
- -
[識別コードの表記 @: メーカーロゴ]
効能効果
骨髄線維症。
(効能又は効果に関連する注意)
5.1. 臨床試験に組み入れられた患者のリスク分類、脾臓の大きさ及び貧血の状態等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。特に、JAK阻害剤による治療歴のない患者への投与については、他の治療の実施についても慎重に検討すること〔17.1.1、17.1.2参照〕。
5.2. 病理組織学的検査を行い、骨髄線維症と診断された患者に使用すること。
用法用量
通常、成人にはモメロチニブとして200mgを1日1回経口投与する。なお、患者の状態により適宜減量する。
(用法及び用量に関連する注意)
7.1. 他の抗悪性腫瘍剤との併用について、有効性及び安全性は確立していない。
7.2. 重度肝機能障害<Child-Pugh分類C>を有する患者に投与する場合は、本剤150mgを開始用量とすること〔9.3.1、16.6.2参照〕。
7.3. 本剤投与により副作用が発現した場合には、次を参考に、本剤を休薬又は減量すること(副作用による減量後、忍容性が認められ、十分な効果が認められない場合は、50mgずつ増量することができる)。
1). 血小板減少:
①. 血小板数25000/mm3以上50000/mm3未満(本剤投与開始前の血小板数が100000/mm3以上の場合);50mg減量を考慮する(100mg投与時の場合には50000/mm3以上に回復するまで休薬を考慮し、休薬後に再開する場合には、100mgで再開する)。
②. 血小板数25000/mm3未満;ベースライン又は50000/mm3以上に回復するまで休薬を考慮し、休薬後に再開する場合には、休薬前の用量から50mg減量する(休薬前の用量が100mgの場合には100mgで再開する)。
2). 好中球減少:好中球数500/mm3未満;750/mm3以上に回復するまで休薬し、休薬後に再開する場合には、休薬前の用量から50mg減量する(休薬前の用量が100mgの場合には100mgで再開する)。
3). 非血液学的有害事象:*グレード3以上の非血液学的有害事象;グレード1以下又はベースラインに回復するまで休薬し、休薬後に再開する場合には、休薬前の用量から50mg減量する(休薬前の用量が100mgの場合には100mgで再開する)。
*)NCI-CTCAE Version5.0に準じる。
外形画像

改訂情報
-
医師の処方により使用する医薬品。
特定薬剤管理指導加算等の算定対象となる薬剤。



 で医薬品を比較する
で医薬品を比較する
