アレセンサカプセル150mg
医療用
医療用医薬品:
医師の処方により使用する医薬品
医師の処方により使用する医薬品
- 収載区分
- 銘柄別収載
- 先発・後発情報
- 先発品(後発品なし)
- オーソライズド
ジェネリック - -
- 一般名
- アレクチニブ塩酸塩カプセル
- 英名(商品名)
- Alecensa
- 規格
- 150mg1カプセル
- 薬価
- 6,737.10
- メーカー名
- 中外製薬
- 規制区分
- 劇薬
- 長期投与制限
- -
- 標榜薬効
- 抗悪性腫瘍薬〔未分化リンパ腫キナーゼ(ALK)阻害薬〕
- 色
- 白〜帯黄白:白〜帯黄白
- 識別コード
- (本体)ALE 150mg (被包)ALE/150mg
- [@: メーカーロゴ]
- 添付文書
-
PDF 2024年8月改訂(第2版)
- 告示日
- 2015年11月27日
- 経過措置期限
- -
- 医薬品マスタに反映
- 2015年12月版
- 医薬品マスタ削除予定
- -
- 運転注意
- 情報なし(使用の適否を判断するものではありません)
- ドーピング
- 禁止物質なし(使用の適否を判断するものではありません)
- CP換算
- -
- 長期収載品選定療養
- -
[識別コードの表記 @: メーカーロゴ]
効能効果
1). ALK融合遺伝子陽性の切除不能な進行・再発の非小細胞肺癌。
2). ALK融合遺伝子陽性の非小細胞肺癌における術後補助療法。
3). 再発又は難治性のALK融合遺伝子陽性の未分化大細胞リンパ腫。
(効能又は効果に関連する注意)
5.1. 〈ALK融合遺伝子陽性の切除不能な進行・再発の非小細胞肺癌、ALK融合遺伝子陽性の非小細胞肺癌における術後補助療法〉*十分な経験を有する病理医又は検査施設における検査により、ALK融合遺伝子陽性が確認された患者に投与すること(検査にあたっては、承認された体外診断用医薬品又は医療機器を用いること)。
5.2. 〈ALK融合遺伝子陽性の切除不能な進行・再発の非小細胞肺癌、ALK融合遺伝子陽性の非小細胞肺癌における術後補助療法〉本剤の術前補助療法における安全性及び有効性は確立していない。
5.3. 〈ALK融合遺伝子陽性の切除不能な進行・再発の非小細胞肺癌、ALK融合遺伝子陽性の非小細胞肺癌における術後補助療法〉術後補助療法として本剤を投与する場合には、臨床試験に組み入れられた患者の病期等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。
5.4. 〈再発又は難治性のALK融合遺伝子陽性の未分化大細胞リンパ腫〉十分な経験を有する病理医又は検査施設における検査により、ALK融合遺伝子陽性が確認された患者に投与すること。
*)承認された体外診断用医薬品又は医療機器に関する情報については、次のウェブサイトから入手可能である:
https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html。
用法用量
〈ALK融合遺伝子陽性の切除不能な進行・再発の非小細胞肺癌〉
通常、成人にはアレクチニブとして1回300mgを1日2回経口投与する。
〈ALK融合遺伝子陽性の非小細胞肺癌における術後補助療法〉
通常、成人にはアレクチニブとして1回600mgを1日2回、食後に経口投与する。ただし、ALK融合遺伝子陽性の非小細胞肺癌における術後補助療法の場合、投与期間は24カ月間までとする。なお、患者の状態により適宜減量する。
〈再発又は難治性のALK融合遺伝子陽性の未分化大細胞リンパ腫〉
通常、アレクチニブとして1回300mgを1日2回経口投与する。ただし、体重35kg未満の場合の1回投与量は150mgとする。
(用法及び用量に関連する注意)
〈ALK融合遺伝子陽性の切除不能な進行・再発の非小細胞肺癌、再発又は難治性のALK融合遺伝子陽性の未分化大細胞リンパ腫〉副作用により休薬する場合、回復後は休薬前と同一用量で投与を再開できる(忍容性が得られない場合は、投与を中止すること)。
〈ALK融合遺伝子陽性の非小細胞肺癌における術後補助療法〉
副作用が発現した場合には、次の基準を考慮して、休薬、減量又は中止すること。
[減量の目安]
1). 〈ALK融合遺伝子陽性の非小細胞肺癌における術後補助療法〉通常投与量:1回投与量600mg。
2). 〈ALK融合遺伝子陽性の非小細胞肺癌における術後補助療法〉1段階減量:1回投与量450mg。
3). 〈ALK融合遺伝子陽性の非小細胞肺癌における術後補助療法〉2段階減量:1回投与量300mg。
4). 〈ALK融合遺伝子陽性の非小細胞肺癌における術後補助療法〉3段階減量:投与中止。
[副作用発現時の用量調節基準]
1). 〈ALK融合遺伝子陽性の非小細胞肺癌における術後補助療法〉間質性肺疾患:全Grade:投与を中止する。
2). 〈ALK融合遺伝子陽性の非小細胞肺癌における術後補助療法〉肝機能障害:
①. 〈ALK融合遺伝子陽性の非小細胞肺癌における術後補助療法〉総ビリルビンが基準値上限の2倍以下でALTが基準値上限の5倍を超える上昇又は総ビリルビンが基準値上限の2倍以下でASTが基準値上限の5倍を超える上昇:ALT又はASTがベースライン又は基準値上限の3倍以下に回復するまで休薬し、回復後は1用量レベル減量して投与再開できる。
②. 〈ALK融合遺伝子陽性の非小細胞肺癌における術後補助療法〉総ビリルビンが基準値上限の2倍を超えALTが基準値上限の3倍を超える上昇又は総ビリルビンが基準値上限の2倍を超えASTが基準値上限の3倍を超える上昇:投与を中止する。
3). 〈ALK融合遺伝子陽性の非小細胞肺癌における術後補助療法〉徐脈:
①. 〈ALK融合遺伝子陽性の非小細胞肺癌における術後補助療法〉Grade2の徐脈又はGrade3の徐脈:Grade1以下又は心拍数が60回/分以上に回復するまで休薬し、回復後は1用量レベル減量して投与再開できる。
②. 〈ALK融合遺伝子陽性の非小細胞肺癌における術後補助療法〉Grade4の徐脈:投与を中止する。
4). 〈ALK融合遺伝子陽性の非小細胞肺癌における術後補助療法〉血中CK増加:
①. 〈ALK融合遺伝子陽性の非小細胞肺癌における術後補助療法〉CKが基準値上限の5倍を超えた場合:ベースライン又は基準値上限の2.5倍以下に回復するまで休薬し、回復後は1用量レベル減量又は同一用量で投与再開できる。
②. 〈ALK融合遺伝子陽性の非小細胞肺癌における術後補助療法〉CKが基準値上限の10倍を超えた場合:ベースライン又は基準値上限の2.5倍以下に回復するまで休薬し、回復後は1用量レベル減量して投与再開できる。
5). 〈ALK融合遺伝子陽性の非小細胞肺癌における術後補助療法〉溶血性貧血:ヘモグロビン10g/dL未満の溶血性貧血:ヘモグロビン10g/dL以上に回復するまで休薬し、回復後は1用量レベル減量して投与再開できる。
GradeはNCI-CTCAEv5.0に準じる。
外形画像
改訂情報
2024年10月22日 DSU No.330 【その他】
【5.効能又は効果に関連する注意】(一部改訂)
〈ALK融合遺伝子陽性の切除不能な進行・再発の非小細胞肺癌、ALK融合遺伝子陽性の非小細胞肺癌における術後補助療法〉
十分な経験を有する病理医又は検査施設における検査により、ALK融合遺伝子陽性が確認された患者に投与すること。検査にあたっては、承認された体外診断用医薬品又は医療機器注)を用いること。
注)承認された体外診断用医薬品又は医療機器に関する情報については、以下のウェブサイトから入手可能である:
https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html
【5.効能又は効果に関連する注意】(一部改訂)
本剤の術前補助療法における安全性及び有効性は確立していない。
【5.効能又は効果に関連する注意】(追記)
術後補助療法として本剤を投与する場合には、臨床試験に組み入れられた患者の病期等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。
【6.用法及び用量】(追記)
〈ALK融合遺伝子陽性の非小細胞肺癌における術後補助療法〉
通常、成人にはアレクチニブとして1回600mgを1日2回、食後に経口投与する。ただし、投与期間は24カ月間までとする。なお、患者の状態により適宜減量する。
【7.用法及び用量に関連する注意】(新設)
〈ALK融合遺伝子陽性の切除不能な進行・再発の非小細胞肺癌、再発又は難治性のALK融合遺伝子陽性の未分化大細胞リンパ腫〉
副作用により休薬する場合、回復後は休薬前と同一用量で投与を再開できる。忍容性が得られない場合は、投与を中止すること。
【7.用法及び用量に関連する注意】(新設)
〈ALK融合遺伝子陽性の非小細胞肺癌における術後補助療法〉
副作用が発現した場合には、以下の基準を考慮して、休薬、減量又は中止すること。
減量の目安
【7.用法及び用量に関連する注意】(新設)
副作用発現時の用量調節基準
【7.用法及び用量に関連する注意】(新設)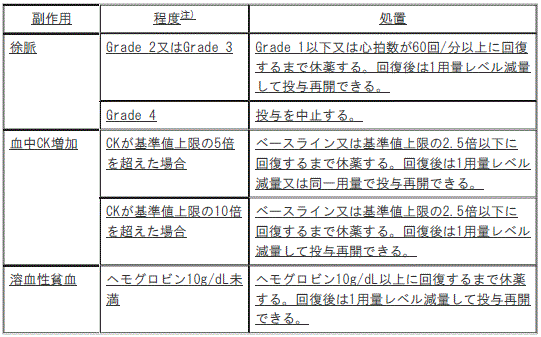
注)GradeはNCI-CTCAEv5.0に準じる。
【8.重要な基本的注意】(追記)
腎機能障害があらわれることがあるので、本剤投与中は定期的に腎機能検査を行い、患者の状態を十分に観察すること。
【9.3肝機能障害患者】(追記)
〈ALK融合遺伝子陽性の非小細胞肺癌における術後補助療法〉
重度の肝機能障害(Child-Pugh分類C)のある患者:
減量を考慮するとともに、患者の状態をより慎重に観察し、副作用の発現に十分注意すること。アレクチニブの血漿中濃度が上昇し、副作用が増強されるおそれがある。
【9.4生殖能を有する者】(一部改訂)
妊娠する可能性のある女性には、本剤投与中及び最終投与後1カ月間において避妊する必要性及び適切な避妊法について説明すること。
【9.7小児等】(一部改訂)
〈ALK融合遺伝子陽性の切除不能な進行・再発の非小細胞肺癌、ALK融合遺伝子陽性の非小細胞肺癌における術後補助療法〉
小児等を対象とした臨床試験は実施していない。
【10.相互作用】(一部改訂)
アレクチニブは、チトクロームP450(主にCYP3A4)によって代謝される。
【10.相互作用】(削除)
また、in vitro試験においてP-糖蛋白及び乳癌耐性蛋白(BCRP)の阻害が認められた。
【10.2併用注意】(一部改訂)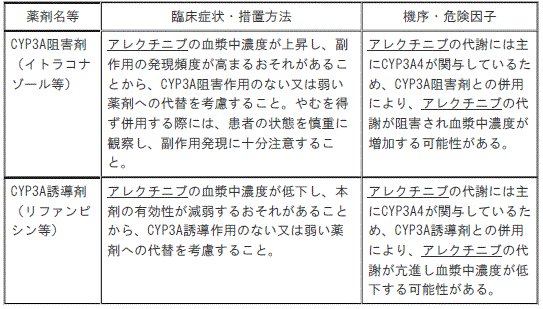
【11.1重大な副作用】(追記)
腎機能障害
【11.2その他の副作用】(一部改訂)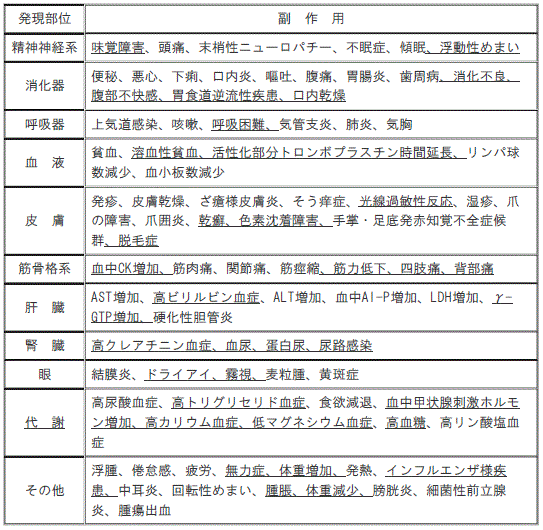
【11.2その他の副作用】(削除)
【15.2非臨床試験に基づく情報】(削除)
ラットを用いた反復投与毒性試験において、切歯への影響(白色化及び短縮)並びに大腿骨及び胸骨への影響(活性化破骨細胞の増加及び骨梁の減少)が認められたが、臨床推奨用量での曝露量の1.9倍相当では認められなかった。
よく一緒に見られている薬
医師の処方により使用する医薬品。
特定薬剤管理指導加算等の算定対象となる薬剤。



 で医薬品を比較する
で医薬品を比較する
