レットヴィモカプセル40mg
医療用
医療用医薬品:
医師の処方により使用する医薬品
医師の処方により使用する医薬品
- 収載区分
- 銘柄別収載
- 先発・後発情報
- 先発品(後発品なし)
- オーソライズド
ジェネリック - -
- 一般名
- セルペルカチニブカプセル
- 英名(商品名)
- Retevmo
- 規格
- 40mg1カプセル
- 薬価
- 4,066.20
- メーカー名
- 日本イーライリリー
- 規制区分
- 劇薬
- 長期投与制限
- -
- 標榜薬効
- 抗悪性腫瘍薬〔RET受容体型チロシンキナーゼ阻害剤〕
- 色
- 灰:灰
- 識別コード
- (本体)@ 3977 40mg (本体)Lilly 3977 40mg (被包)@ 3977 (被包)Lilly 3977 (被包)@ (被包)Lilly
- [@: メーカーロゴ]
- 添付文書
-
PDF 2024年6月改訂(第6版)
- 告示日
- 2021年11月24日
- 経過措置期限
- -
- 医薬品マスタに反映
- 2021年12月版
- 医薬品マスタ削除予定
- -
- 運転注意
- 情報なし(使用の適否を判断するものではありません)
- ドーピング
- 禁止物質なし(使用の適否を判断するものではありません)
- CP換算
- -
- 長期収載品選定療養
- -
[識別コードの表記 @: メーカーロゴ]
効能効果
1). RET融合遺伝子陽性の進行・再発の固形腫瘍。
2). RET遺伝子変異陽性の根治切除不能な甲状腺髄様癌。
(効能又は効果に関連する注意)
5.1. 〈RET融合遺伝子陽性の進行・再発の非小細胞肺癌〉*十分な経験を有する病理医又は検査施設における検査により、RET融合遺伝子陽性が確認された患者に投与すること(検査にあたっては、承認された体外診断用医薬品又は医療機器を用いること)。
5.2. 〈RET融合遺伝子陽性の進行・再発の非小細胞肺癌〉「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、本剤以外の治療の実施についても慎重に検討し、適応患者の選択を行うこと〔17.1.1参照〕。
5.3. 〈RET融合遺伝子陽性の進行・再発の非小細胞肺癌〉本剤の術後補助療法における有効性及び安全性は確立していない。
5.4. 〈RET融合遺伝子陽性の進行・再発の甲状腺癌〉*十分な経験を有する病理医又は検査施設における検査により、RET融合遺伝子陽性が確認された患者に投与すること(検査にあたっては、承認された体外診断用医薬品又は医療機器を用いること)。
5.5. 〈RET融合遺伝子陽性の進行・再発の甲状腺癌〉RET融合遺伝子陽性の進行・再発の甲状腺癌の場合、放射性ヨウ素による治療の適応となる患者においては、当該治療を優先すること。
5.6. 〈RET融合遺伝子陽性の進行・再発固形腫瘍<非小細胞肺癌・甲状腺癌を除く>〉*十分な経験を有する病理医又は検査施設における検査により、RET融合遺伝子陽性が確認された患者に投与すること(検査にあたっては、承認された体外診断用医薬品又は医療機器を用いること)。
5.7. 〈RET融合遺伝子陽性の進行・再発固形腫瘍<非小細胞肺癌・甲状腺癌を除く>〉組織球症患者は本剤の投与対象となり得る。
5.8. 〈RET融合遺伝子陽性の進行・再発固形腫瘍<非小細胞肺癌・甲状腺癌を除く>〉臨床試験に組み入れられた患者のがん種等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、本剤以外の治療の実施についても慎重に検討し、適応患者の選択を行うこと〔17.1.1参照〕。
5.9. 〈RET融合遺伝子陽性の進行・再発固形腫瘍<非小細胞肺癌・甲状腺癌を除く>〉本剤の手術の補助療法における有効性及び安全性は確立していない。
5.10. 〈RET遺伝子変異陽性の根治切除不能な甲状腺髄様癌〉*十分な経験を有する病理医又は検査施設における検査により、RET遺伝子変異が確認された患者に投与すること(生殖細胞系列のRET遺伝子変異が陰性又は不明の場合は、承認された体外診断用医薬品又は医療機器を用いて検査を行うこと)。
5.11. 〈RET遺伝子変異陽性の根治切除不能な甲状腺髄様癌〉「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、本剤以外の治療の実施についても慎重に検討し、適応患者の選択を行うこと〔17.1.1参照〕。
*)承認された体外診断用医薬品又は医療機器に関する情報については、次のウェブサイトから入手可能である:
https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html。
用法用量
通常、成人にはセルペルカチニブとして1回160mgを1日2回経口投与する。なお、患者の状態により適宜減量する。
通常、12歳以上の小児には体表面積に合わせて次の投与量(セルペルカチニブとして1回約92mg/㎡)を1日2回経口投与する。なお、患者の状態により適宜減量する。
[小児の用量]
1). 体表面積1.2㎡未満:1回投与量80mg。
2). 体表面積1.2㎡以上1.6㎡未満:1回投与量120mg。
3). 体表面積1.6㎡以上:1回投与量160mg。
(用法及び用量に関連する注意)
7.1. 他の抗悪性腫瘍剤との併用について、有効性及び安全性は確立していない。
7.2. 本剤投与により副作用が発現した場合には、次の基準を考慮して、休薬・減量・中止すること。
[成人の場合 本剤の減量の目安]
1). 通常投与量:1回160mg1日2回。
2). 1段階減量:1回120mg1日2回。
3). 2段階減量:1回80mg1日2回。
4). 3段階減量:1回40mg1日2回。
[小児の場合 本剤の減量の目安]
1). 体表面積1.2㎡未満:
①. 通常投与量:1回80mg1日2回。
②. 1段階減量:1回40mg/1回80mg1日2回(1日量120mg)。
③. 2段階減量:1回40mg1日2回。
④. 3段階減量*:1回40mg1日1回。
2). 体表面積1.2㎡以上1.6㎡未満:
①. 通常投与量:1回120mg1日2回。
②. 1段階減量:1回80mg1日2回。
③. 2段階減量:1回40mg/1回80mg1日2回(1日量120mg)。
④. 3段階減量*:1回40mg1日1回。
3). 体表面積1.6㎡以上:
①. 通常投与量:1回160mg1日2回。
②. 1段階減量:1回120mg1日2回。
③. 2段階減量:1回80mg1日2回。
④. 3段階減量:1回40mg1日2回。
*)過敏症発現時のみ(過敏症以外で2段階減量において忍容性が得られない場合、投与中止)。
[副作用に対する休薬、減量及び中止基準]
1). グレード3のALT増加又はグレード3のAST増加又はグレード4のALT増加又はグレード4のAST増加:グレード1以下に回復するまで休薬し、回復後は2段階減量して投与再開できる(再開後に2週間以上再発しない場合には、1段階増量することができ、更に4週間以上再発しない場合には、もう1段階増量することができるが、減量した用量で投与中に再発した場合には、中止する)。
2). QT間隔延長:
①. QTc間隔>500msec:QTc間隔<470msecに回復するまで休薬し、回復後は1段階減量して投与再開できる(2段階減量した用量で投与中に再発した場合には、中止する)。
②. QT間隔延長で重篤な不整脈を疑う所見や症状が認められた場合:中止する。
3). グレード3の高血圧又はグレード4の高血圧:回復するまで休薬し、回復後は1段階減量して投与再開できる。
4). グレード1~4の過敏症<アナフィラキシー等の重篤な過敏症を除く>〔11.1.3参照〕:回復するまで休薬し、副腎皮質ステロイドの全身投与を考慮し、回復後は副腎皮質ステロイドを併用しながら3段階減量して投与再開できる(再開後に7日以上再発しない場合には、1段階ずつ発現時の用量まで増量でき、増量後に7日以上再発しない場合には、副腎皮質ステロイドを漸減する)。
5). 間質性肺疾患:
①. グレード2の間質性肺疾患:回復するまで休薬し、回復後は1段階減量して投与再開できる。
②. グレード3の間質性肺疾患又はグレード4の間質性肺疾患:中止する。
6). 前記以外のグレード3の副作用又はグレード4の副作用:回復するまで休薬し、回復後は1段階減量して投与再開できる。
グレードはNCI-CTCAE ver.4.03に準じる。
外形画像
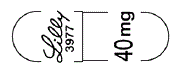
改訂情報
2024年7月31日 DSU No.328 【その他】
【5.効能又は効果に関連する注意】(一部改訂)
〈RET融合遺伝子陽性の進行・再発の非小細胞肺癌〉
十分な経験を有する病理医又は検査施設における検査により、RET融合遺伝子陽性が確認された患者に投与すること。検査にあたっては、承認された体外診断用医薬品又は医療機器を用いること。
【5.効能又は効果に関連する注意】(一部改訂)
〈RET融合遺伝子陽性の進行・再発の甲状腺癌〉
十分な経験を有する病理医又は検査施設における検査により、RET融合遺伝子陽性が確認された患者に投与すること。検査にあたっては、承認された体外診断用医薬品又は医療機器を用いること。
【5.効能又は効果に関連する注意】(追記)
〈RET融合遺伝子陽性の進行・再発の固形腫瘍(非小細胞肺癌及び甲状腺癌を除く)〉
十分な経験を有する病理医又は検査施設における検査により、RET融合遺伝子陽性が確認された患者に投与すること。検査にあたっては、承認された体外診断用医薬品又は医療機器を用いること。
【5.効能又は効果に関連する注意】(追記)
組織球症患者は本剤の投与対象となり得る。
【5.効能又は効果に関連する注意】(追記)
臨床試験に組み入れられた患者のがん種等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、本剤以外の治療の実施についても慎重に検討し、適応患者の選択を行うこと。
【5.効能又は効果に関連する注意】(追記)
本剤の手術の補助療法における有効性及び安全性は確立していない。
【5.効能又は効果に関連する注意】(一部改訂)
〈RET遺伝子変異陽性の根治切除不能な甲状腺髄様癌〉
十分な経験を有する病理医又は検査施設における検査により、RET遺伝子変異が確認された患者に投与すること。生殖細胞系列のRET遺伝子変異が陰性又は不明の場合は、承認された体外診断用医薬品又は医療機器を用いて検査を行うこと。
【9.4生殖能を有する者】(一部改訂)
妊娠する可能性のある女性には、本剤投与中及び最終投与後1ヵ月間において避妊する必要性及び適切な避妊法について説明すること。
【9.4生殖能を有する者】(一部改訂)
男性には、本剤投与中及び最終投与後1週間においてバリア法(コンドーム)を用いて避妊する必要性について説明すること。
【9.7小児等】(一部改訂)
成長期にある若年者においては、骨成長について以下の点に注意すること。
・骨端線に異常がないか十分に観察すること。骨端線に異常が認められた場合には、投与継続の可否を慎重に判断すること。
・関節痛及び歩行障害について十分に観察すること。大腿骨頭すべり症等の骨端離開があらわれることがある。
【11.2その他の副作用】(一部改訂)
よく一緒に見られている薬
医師の処方により使用する医薬品。
特定薬剤管理指導加算等の算定対象となる薬剤。



 で医薬品を比較する
で医薬品を比較する
