エザルミア錠50mg
医療用
医療用医薬品:
医師の処方により使用する医薬品
医師の処方により使用する医薬品
- 収載区分
- 銘柄別収載
- 先発・後発情報
- 先発品(後発品なし)
- オーソライズド
ジェネリック - -
- 一般名
- バレメトスタットトシル酸塩錠
- 英名(商品名)
- Ezharmia
- 規格
- 50mg1錠
- 薬価
- 6,267.70
- メーカー名
- 第一三共
- 規制区分
- 劇薬
- 長期投与制限
- -
- 標榜薬効
- 抗悪性腫瘍薬〔ヒストンメチル基転移酵素(HMT)阻害薬〕
- 色
- 白
- 識別コード
- (本体)DSC531 50 (本体)DSC531 50 (被包)DSC 531 50mg (被包)@ EZHARMIA 50mg
- [@: メーカーロゴ]
- 添付文書
-
PDF 2024年6月改訂(第3版)
- 告示日
- 2022年11月15日
- 経過措置期限
- -
- 医薬品マスタに反映
- 2022年12月版
- 医薬品マスタ削除予定
- -
- 運転注意
- 情報なし(使用の適否を判断するものではありません)
- ドーピング
- 禁止物質なし(使用の適否を判断するものではありません)
- CP換算
- -
- 長期収載品選定療養
- -
[識別コードの表記 @: メーカーロゴ]
効能効果
1). 再発又は難治性の成人T細胞白血病リンパ腫。
2). 再発又は難治性の末梢性T細胞リンパ腫。
(効能又は効果に関連する注意)
5.1. 〈再発又は難治性の成人T細胞白血病リンパ腫〉臨床試験に組み入れられた患者の病型及び予後不良因子の有無等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと〔17.1.1参照〕。
5.2. 〈再発又は難治性の末梢性T細胞リンパ腫〉本剤投与の適応となる疾患の診断は、病理診断に十分な経験を持つ医師又は施設により行うこと。
5.3. 〈再発又は難治性の末梢性T細胞リンパ腫〉臨床試験に組み入れられた患者の病理組織型等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと〔17.1.2参照〕。
用法用量
通常、成人にはバレメトスタットとして200mgを1日1回空腹時に経口投与する。なお、患者の状態により適宜減量する。
(用法及び用量に関連する注意)
7.1. 他の抗悪性腫瘍剤との併用について、有効性及び安全性は確立していない。
7.2. 食後に本剤を投与した場合、Cmax低下及びAUC低下するとの報告がある。食事の影響を避けるため、食事の1時間前から食後2時間までの間の服用は避けること〔16.2.1参照〕。
7.3. 本剤投与により副作用が発現した場合には、次の基準を参考に、本剤を休薬、減量又は中止すること。なお、副作用による減量は2用量レベルまでとすること〔8.重要な基本的注意の項、11.1.1参照〕。
7.3.1. 〈効能共通〉減量・中止する場合の投与量
1). 用量レベル1:200mg。
2). 用量レベル2:150mg。
3). 用量レベル3:100mg。
4). 用量レベル4:50mg。
5). 中止:50mgで忍容性が得られない場合、投与を中止する。
7.3.2. 〈再発又は難治性の成人T細胞白血病リンパ腫〉副作用発現時の本剤の用量調節基準
1). 〈再発又は難治性の成人T細胞白血病リンパ腫〉好中球減少:好中球数500/mm3未満が7日間を超えて継続;好中球数が1000/mm3以上又はベースラインに回復するまで休薬し、回復後に再開する場合は、休薬前の用量で投与する(再開した後に再び発現した場合、好中球数が1000/mm3以上又はベースラインに回復するまで休薬し、回復後に再開する場合は、休薬前の用量から1用量レベル減量する)。
2). 〈再発又は難治性の成人T細胞白血病リンパ腫〉血小板減少:血小板数25000/mm3未満;血小板数が50000/mm3以上又はベースラインに回復するまで休薬し、回復後に再開する場合は、休薬前の用量で投与する(再開した後に再び発現した場合、血小板数が50000/mm3以上又はベースラインに回復するまで休薬し、回復後に再開する場合は、休薬前の用量から1用量レベル減量する)。
3). 〈再発又は難治性の成人T細胞白血病リンパ腫〉貧血:ヘモグロビン値8.0g/dL未満で赤血球輸血を要する貧血;ヘモグロビン値が8.0g/dL以上又はベースラインに回復するまで休薬し、回復後に再開する場合は、休薬前の用量で投与する(再開した後に再び発現した場合、ヘモグロビン値が8.0g/dL以上又はベースラインに回復するまで休薬し、回復後に再開する場合は、休薬前の用量から1用量レベル減量する)。
4). 〈再発又は難治性の成人T細胞白血病リンパ腫〉非血液毒性:*Grade3以上の非血液毒性;*Grade1以下又はベースラインに回復するまで休薬し、回復後に再開する場合は、休薬前の用量で投与する(*再開した後に再び発現した場合、Grade1以下又はベースラインに回復するまで休薬し、回復後に再開する場合は、休薬前の用量から1用量レベル減量する)。
*)GradeはNCI-CTCAEに準じる。
7.3.3. 〈再発又は難治性の末梢性T細胞リンパ腫〉副作用発現時の本剤の用量調節基準
1). 〈再発又は難治性の末梢性T細胞リンパ腫〉好中球減少:好中球数500/mm3未満;好中球数が1000/mm3以上に回復するまで休薬し、回復後に再開する際、持続期間が7日以内の場合は休薬前の用量で再開する(7日間を超えて持続した場合は休薬前の用量から1用量レベル減量し、さらに休薬が必要な場合は、それ以降、1用量レベル減量する)。
2). 〈再発又は難治性の末梢性T細胞リンパ腫〉血小板減少:
①. 〈再発又は難治性の末梢性T細胞リンパ腫〉血小板数50000/mm3未満が7日間を超えて持続;血小板数が50000/mm3以上に回復するまで休薬し、回復後に再開する場合は、休薬前の用量で投与する(再開した後に再び発現した場合、血小板数が50000/mm3以上に回復するまで休薬し、回復後に再開する場合は、休薬前の用量から1用量レベル減量し、減量後再開した後に再び発現した場合は、中止する)。
②. 〈再発又は難治性の末梢性T細胞リンパ腫〉*血小板数50000/mm3未満でGrade2以上の出血を伴う;血小板数が50000/mm3以上に回復するまで休薬し、回復後に再開する場合は、休薬前の用量から1用量レベル減量する(再開した後に再び発現した場合は、中止する)。
③. 〈再発又は難治性の末梢性T細胞リンパ腫〉血小板数25000/mm3未満;血小板数が50000/mm3以上に回復するまで休薬し、回復後に再開する場合は、休薬前の用量から1用量レベル減量し、さらに休薬が必要な場合は、それ以降、1用量レベル減量する)。
3). 〈再発又は難治性の末梢性T細胞リンパ腫〉貧血:ヘモグロビン値8.0g/dL未満で赤血球輸血を要する貧血;直近の輸血から7日以上経過してヘモグロビン値が8.0g/dL以上に回復するまで休薬する(回復後に再開する場合は、休薬前の用量で投与し、さらに休薬が必要な場合は、それ以降、1用量レベル減量する)。
4). 〈再発又は難治性の末梢性T細胞リンパ腫〉非血液毒性:
①. 〈再発又は難治性の末梢性T細胞リンパ腫〉*Grade3で治療を要する非血液毒性;*Grade1以下又はベースラインに回復するまで休薬し、回復後に再開する場合は、休薬前の用量で投与する(同一の副作用によりさらに休薬が必要な場合は、それ以降、1用量レベル減量する)。
②. 〈再発又は難治性の末梢性T細胞リンパ腫〉*Grade4の非血液毒性;*Grade1以下又はベースラインに回復するまで休薬し、回復後に再開する場合は、休薬前の用量から1用量レベル減量する(同一の副作用によりさらに休薬が必要な場合は、中止する)。
*)GradeはNCI-CTCAEに準じる。
7.4. 強いCYP3A阻害剤又はP糖蛋白(P-gp)阻害剤と併用する場合には、本剤の血中濃度が上昇するおそれがあるため、次の基準を参考に、本剤の投与を検討すること〔10.2、16.7.1、16.7.4参照〕。
[CYP3A阻害剤又はP-gp阻害剤との併用時の用量調節基準]
1). 強いCYP3A阻害剤、P-gp阻害剤(本剤の投与量200mg):本剤の投与量を100mgに減量すること。
2). 強いCYP3A阻害剤、P-gp阻害剤(本剤の投与量150mg又は100mg):本剤の投与量を50mgに減量すること。
3). 強いCYP3A阻害剤、P-gp阻害剤(本剤の投与量50mg):本剤を併用しないこと。
4). 強いCYP3A阻害作用及びP-gp阻害作用を有する薬剤(本剤の投与量200mg):本剤の投与量を50mgに減量すること。
5). 強いCYP3A阻害作用及びP-gp阻害作用を有する薬剤(本剤の投与量150mg又は100mg、50mg):本剤を併用しないこと。
外形画像
改訂情報
2024年7月31日 DSU No.328 【その他】
【5.効能又は効果に関連する注意】(追記)
〈再発又は難治性の末梢性T細胞リンパ腫〉
本剤投与の適応となる疾患の診断は、病理診断に十分な経験を持つ医師又は施設により行うこと。
【5.効能又は効果に関連する注意】(追記)
臨床試験に組み入れられた患者の病理組織型等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。
【7.用法及び用量に関連する注意】(一部改訂)
本剤投与により副作用が発現した場合には、次の基準を参考に、本剤を休薬、減量又は中止すること。なお、副作用による減量は2用量レベルまでとすること。
〈効能共通〉
減量・中止する場合の投与量:
【7.用法及び用量に関連する注意】(追記)
〈再発又は難治性の末梢性T細胞リンパ腫〉
副作用発現時の本剤の用量調節基準: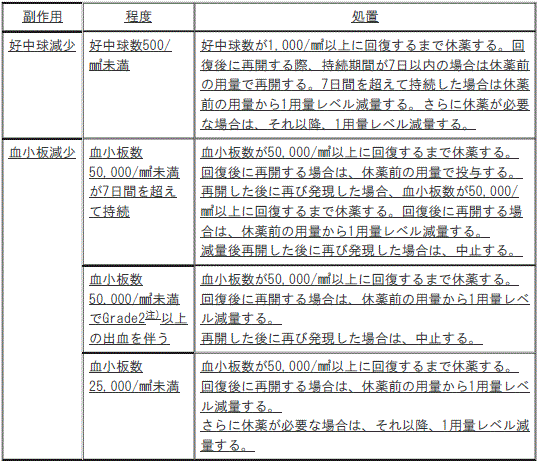
【7.用法及び用量に関連する注意】(追記)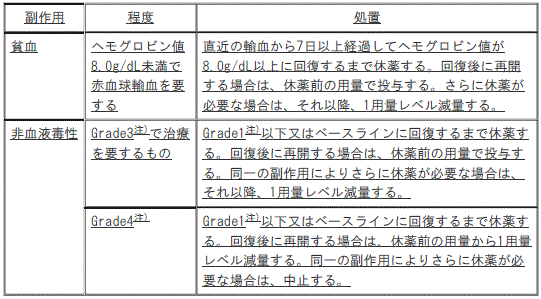
注)GradeはNCI-CTCAEに準じる。
【9.4生殖能を有する者】(一部改訂)
妊娠する可能性のある女性には、本剤投与中及び最終投与後2週間において避妊する必要性及び適切な避妊法について説明すること。
【9.4生殖能を有する者】(一部改訂)
男性には、本剤投与中及び最終投与後2週間においてバリア法(コンドーム)を用いて避妊する必要性について説明すること。精液を介して胎児に悪影響を及ぼす可能性がある。
【9.4生殖能を有する者】(一部改訂)
生殖可能な男性に投与する場合には、造精機能の低下があらわれる可能性があることを考慮すること。動物実験(イヌ、ラット)において、精巣への影響が報告されている。
【11.1重大な副作用】(一部改訂)
感染症:
上気道感染、ニューモシスチス・イロベチイ肺炎等があらわれることがある。
【11.2その他の副作用】(追記)
【11.2その他の副作用】(一部改訂)
【15.1臨床使用に基づく情報】(一部改訂)
臨床試験において、慢性骨髄単球性白血病、慢性白血病、骨髄異形成症候群、急性骨髄性白血病等の二次性悪性腫瘍が発現したとの報告がある。また、小児の神経芽腫患者(承認外効能・効果)で前駆B細胞型急性白血病が発現したとの報告がある。
医師の処方により使用する医薬品。
特定薬剤管理指導加算等の算定対象となる薬剤。



 で医薬品を比較する
で医薬品を比較する
