ターゼナカプセル0.25mg
医療用
医療用医薬品:
医師の処方により使用する医薬品
医師の処方により使用する医薬品
- 収載区分
- 銘柄別収載
- 先発・後発情報
- 先発品(後発品なし)
- オーソライズド
ジェネリック - -
- 一般名
- タラゾパリブトシル酸塩カプセル
- 英名(商品名)
- Talzenna
- 規格
- 0.25mg1カプセル
- 薬価
- 9,576.00
- メーカー名
- ファイザー
- 規制区分
- 劇薬
- 長期投与制限
- 14日(2025年04月末まで)
- 標榜薬効
- 抗悪性腫瘍薬〔ポリアデノシン5’二リン酸リボースポリメラーゼ(PARP)阻害薬〕
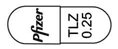
- 色
- 帯黄白:白
- 識別コード
- (本体)@ TLZ 0.25 (本体)Pfizer TLZ 0.25 (被包)TLZ 0.25 @ (被包)TLZ 0.25 @Pfizer
- [@: メーカーロゴ]
- 添付文書
-
PDF 2024年1月改訂(第1版)
- 告示日
- 2024年4月16日
- 経過措置期限
- -
- 医薬品マスタに反映
- 2024年5月版
- DIRに反映
- 2024年5月版
- DIR削除予定
- -
- 運転注意
- 情報なし(使用の適否を判断するものではありません)
- ドーピング
- 禁止物質なし(使用の適否を判断するものではありません)
- CP換算
- -
- 長期収載品選定療養
- -
[識別コードの表記 @: メーカーロゴ]
効能効果
1). BRCA遺伝子変異陽性の遠隔転移を有する去勢抵抗性前立腺癌。
2). がん化学療法歴のあるBRCA遺伝子変異陽性かつHER2陰性の手術不能又は再発乳癌。
(効能又は効果に関連する注意)
5.1. 〈BRCA遺伝子変異陽性の遠隔転移を有する去勢抵抗性前立腺癌〉本剤の術後補助療法における有効性及び安全性は確立していない。
5.2. 〈BRCA遺伝子変異陽性の遠隔転移を有する去勢抵抗性前立腺癌〉承認された体外診断用医薬品又は医療機器を用いた検査により、BRCA遺伝子変異を有することが確認された患者に投与すること。なお、承認された体外診断用医薬品又は医療機器に関する情報については、次のウェブサイトから入手可能である:
https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html。
5.3. 〈がん化学療法歴のあるBRCA遺伝子変異陽性かつHER2陰性の手術不能又は再発乳癌〉本剤の術前・術後薬物療法としての有効性及び安全性は確立していない。
5.4. 〈がん化学療法歴のあるBRCA遺伝子変異陽性かつHER2陰性の手術不能又は再発乳癌〉本剤の投与は、次のいずれかに該当する患者を対象とすること。
・ 〈がん化学療法歴のあるBRCA遺伝子変異陽性かつHER2陰性の手術不能又は再発乳癌〉アントラサイクリン系抗悪性腫瘍剤及びタキサン系抗悪性腫瘍剤を含む化学療法歴のある患者を対象とすること。
・ 〈がん化学療法歴のあるBRCA遺伝子変異陽性かつHER2陰性の手術不能又は再発乳癌〉アントラサイクリン系抗悪性腫瘍剤又はタキサン系抗悪性腫瘍剤のいずれかを含む化学療法歴があり、他方に適応のない患者を対象とすること。
5.5. 〈がん化学療法歴のあるBRCA遺伝子変異陽性かつHER2陰性の手術不能又は再発乳癌〉承認された体外診断用医薬品又は医療機器を用いた検査により、生殖細胞系列のBRCA遺伝子変異(病的変異又は病的変異疑い)を有することが確認された患者に投与すること。なお、承認された体外診断用医薬品又は医療機器に関する情報については、次のウェブサイトから入手可能である:
https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html。
用法用量
1). BRCA遺伝子変異陽性の遠隔転移を有する去勢抵抗性前立腺癌:エンザルタミドとの併用において、通常、成人にはタラゾパリブとして1日1回0.5mgを経口投与する。なお、患者の状態により適宜減量する。
2). がん化学療法歴のあるBRCA遺伝子変異陽性かつHER2陰性の手術不能又は再発乳癌:通常、成人にはタラゾパリブとして1日1回1mgを経口投与する。なお、患者の状態により適宜減量する。
(用法及び用量に関連する注意)
7.1. 〈BRCA遺伝子変異陽性の遠隔転移を有する去勢抵抗性前立腺癌〉他の抗悪性腫瘍剤との併用について、有効性及び安全性は確立していない。
7.2. 〈BRCA遺伝子変異陽性の遠隔転移を有する去勢抵抗性前立腺癌〉外科的又は内科的去勢術と併用しない場合の有効性及び安全性は確立していない。
7.3. 〈BRCA遺伝子変異陽性の遠隔転移を有する去勢抵抗性前立腺癌〉前立腺癌で中等度腎機能障害のある患者(前立腺癌で30mL/分/1.73㎡≦eGFR<60mL/分/1.73㎡)では、本剤1日1回0.35mgを開始用量とすること〔9.2.2、16.6.2参照〕。
7.4. 〈BRCA遺伝子変異陽性の遠隔転移を有する去勢抵抗性前立腺癌〉0.1mgカプセルと0.25mgカプセルの生物学的同等性は示されていないため、0.5mgを投与する際に0.1mgカプセルを使用しないこと。
7.5. 〈BRCA遺伝子変異陽性の遠隔転移を有する去勢抵抗性前立腺癌〉本剤投与により副作用が発現した場合には、次の基準を考慮して休薬・減量・中止すること。
[減量の目安]
1). 〈BRCA遺伝子変異陽性の遠隔転移を有する去勢抵抗性前立腺癌〉通常投与量:1日1回0.5mg。
2). 〈BRCA遺伝子変異陽性の遠隔転移を有する去勢抵抗性前立腺癌〉1段階減量:1日1回0.35mg。
3). 〈BRCA遺伝子変異陽性の遠隔転移を有する去勢抵抗性前立腺癌〉2段階減量:1日1回0.25mg。
4). 〈BRCA遺伝子変異陽性の遠隔転移を有する去勢抵抗性前立腺癌〉3段階減量:1日1回0.1mg。
5). 〈BRCA遺伝子変異陽性の遠隔転移を有する去勢抵抗性前立腺癌〉4段階減量:投与中止。
[副作用に対する休薬及び減量基準]
1). 〈BRCA遺伝子変異陽性の遠隔転移を有する去勢抵抗性前立腺癌〉貧血<ヘモグロビン値8g/dL未満>:ヘモグロビン値が9g/dL以上に回復するまで本剤を休薬し、休薬後、改善した場合は、1段階減量して本剤の投与を再開できる。
2). 〈BRCA遺伝子変異陽性の遠隔転移を有する去勢抵抗性前立腺癌〉血小板減少<血小板数50000/μL未満>:①初発の場合、血小板数が50000/μL以上に回復するまで本剤を休薬し、休薬後、改善した場合は、1段階減量して本剤の投与を再開できる、②再発した場合、血小板数が75000/μL以上に回復するまで本剤を休薬し、休薬後、改善した場合は、1段階減量して本剤の投与を再開できる。
3). 〈BRCA遺伝子変異陽性の遠隔転移を有する去勢抵抗性前立腺癌〉好中球減少<好中球数1000/μL未満>:好中球数が1500/μL以上に回復するまで本剤を休薬し、休薬後、改善した場合は、1段階減量して本剤の投与を再開できる。
4). 〈BRCA遺伝子変異陽性の遠隔転移を有する去勢抵抗性前立腺癌〉前記以外の副作用<Grade3>又は副作用<Grade4>:Grade1以下に回復するまで本剤を休薬し、休薬後、改善した場合は、1段階減量して本剤の投与を再開できる。
GradeはNCI-CTCAE ver.4.03に準じる。
7.6. 〈がん化学療法歴のあるBRCA遺伝子変異陽性かつHER2陰性の手術不能又は再発乳癌〉他の抗悪性腫瘍剤との併用について、有効性及び安全性は確立していない。
7.7. 〈がん化学療法歴のあるBRCA遺伝子変異陽性かつHER2陰性の手術不能又は再発乳癌〉乳癌で中等度腎機能障害のある患者(乳癌でeGFR30mL/分/1.73㎡以上60mL/分/1.73㎡未満)では、本剤1日1回0.75mgを開始用量とすること〔9.2.2、16.6.2参照〕。
7.8. 〈がん化学療法歴のあるBRCA遺伝子変異陽性かつHER2陰性の手術不能又は再発乳癌〉1mgカプセルと0.25mgカプセルの生物学的同等性は示されていないため、1mgを投与する際に0.25mgカプセルを使用しないこと。
7.9. 〈がん化学療法歴のあるBRCA遺伝子変異陽性かつHER2陰性の手術不能又は再発乳癌〉本剤投与により副作用が発現した場合には、次の基準を考慮して休薬・減量・中止すること。
[減量の目安]
1). 〈がん化学療法歴のあるBRCA遺伝子変異陽性かつHER2陰性の手術不能又は再発乳癌〉通常投与量:1日1回1mg。
2). 〈がん化学療法歴のあるBRCA遺伝子変異陽性かつHER2陰性の手術不能又は再発乳癌〉1段階減量:1日1回0.75mg。
3). 〈がん化学療法歴のあるBRCA遺伝子変異陽性かつHER2陰性の手術不能又は再発乳癌〉2段階減量:1日1回0.5mg。
4). 〈がん化学療法歴のあるBRCA遺伝子変異陽性かつHER2陰性の手術不能又は再発乳癌〉3段階減量:1日1回0.25mg。
5). 〈がん化学療法歴のあるBRCA遺伝子変異陽性かつHER2陰性の手術不能又は再発乳癌〉4段階減量:投与中止。
[副作用に対する休薬及び減量基準]
1). 〈がん化学療法歴のあるBRCA遺伝子変異陽性かつHER2陰性の手術不能又は再発乳癌〉貧血<ヘモグロビン値8g/dL未満>:ヘモグロビン値が9g/dL以上に回復するまで本剤を休薬し、休薬後、改善した場合は、1段階減量して本剤の投与を再開できる。
2). 〈がん化学療法歴のあるBRCA遺伝子変異陽性かつHER2陰性の手術不能又は再発乳癌〉血小板減少<血小板数50000/μL未満>:血小板数が75000/μL以上に回復するまで本剤を休薬し、休薬後、改善した場合は、1段階減量して本剤の投与を再開できる。
3). 〈がん化学療法歴のあるBRCA遺伝子変異陽性かつHER2陰性の手術不能又は再発乳癌〉好中球減少<好中球数1000/μL未満>:好中球数が1500/μL以上に回復するまで本剤を休薬し、休薬後、改善した場合は、1段階減量して本剤の投与を再開できる。
4). 〈がん化学療法歴のあるBRCA遺伝子変異陽性かつHER2陰性の手術不能又は再発乳癌〉前記以外の副作用<Grade3>又は副作用<Grade4>:Grade1以下に回復するまで本剤を休薬し、休薬後、改善した場合は、1段階減量して本剤の投与を再開できる。
GradeはNCI-CTCAE ver.4.03に準じる。
外形画像
改訂情報
-
医師の処方により使用する医薬品。
特定薬剤管理指導加算等の算定対象となる薬剤。


