ツルバダ配合錠
医療用
医療用医薬品:
医師の処方により使用する医薬品
医師の処方により使用する医薬品
- 収載区分
- 銘柄別収載
- 先発・後発情報
- 先発品(後発品なし)
- オーソライズド
ジェネリック - -
- 一般名
- エムトリシタビン・テノホビル ジソプロキシルフマル酸塩錠
- 英名(商品名)
- Truvada
- 規格
- 1錠
- 薬価
- 2,442.40
- メーカー名
- ギリアド・サイエンシズ
- 規制区分
- 劇薬
- 長期投与制限
- -
- 標榜薬効
- 抗HIV薬〔核酸(ヌクレオシド)系HIV逆転写酵素阻害薬(NRTI)〕
- 色
- 青
- 識別コード
- (本体)GILEAD (本体)701
- [@: メーカーロゴ]
- 添付文書
-
PDF 2024年8月改訂(第4版)
- 告示日
- 2009年9月25日
- 経過措置期限
- -
- 医薬品マスタに反映
- -
- 医薬品マスタ削除予定
- -
- 運転注意
- 情報なし(使用の適否を判断するものではありません)
- ドーピング
- 禁止物質なし(使用の適否を判断するものではありません)
- CP換算
- -
- 長期収載品選定療養
- -
[識別コードの表記 @: メーカーロゴ]
効能効果
1). HIV-1感染症。
2). HIV-1感染症の曝露前予防。
(効能又は効果に関連する注意)
5.1. 〈曝露前予防〉本剤は、HIV-1感染症の曝露前予防に関する国内外のガイドライン等の最新の情報を参考に、HIV-1感染リスクの高い者における性的接触によるHIV-1感染の予防にのみ使用すること。
5.2. 〈曝露前予防〉本剤はHIV-1感染症を完全に予防できるとは限らないため、本剤を使用する場合は、他のHIV-1感染予防手段(コンドームの使用、パートナーのHIV-1感染状態の把握、性感染症の定期的な検査等)と併用して使用すること。
5.3. 〈曝露前予防〉本剤単独ではHIV-1感染症に対する治療としては不十分であり、薬剤耐性変異を誘導する可能性があるため、本剤を使用する場合は、検査によりHIV-1陰性であることを確認すること(急性HIV-1感染症と一致する臨床症状がある場合は、本剤を投与しないこと)。
用法用量
1). HIV-1感染症
通常、成人には1回1錠(エムトリシタビンとして200mg及びテノホビル ジソプロキシルフマル酸塩として300mgを含有)を1日1回経口投与する。なお、治療の場合、投与に際しては必ず他の抗HIV薬と併用すること。
2). HIV-1感染症の曝露前予防
通常、成人には1回1錠(エムトリシタビンとして200mg及びテノホビル ジソプロキシルフマル酸塩として300mgを含有)を1日1回経口投与する。
(用法及び用量に関連する注意)
7.1. 〈効能共通〉エムトリシタビンを含む製剤及びテノホビル ジソプロキシルフマル酸塩を含む製剤と併用しないこと。また、テノホビル アラフェナミドフマル酸塩を含む製剤についても併用しないこと。
7.2. 〈治療〉本剤の有効成分であるエムトリシタビンの薬剤耐性を含むウイルス学的特性はラミブジンと類似しているので、本剤とラミブジンを含む製剤を併用しないこと。また、治療の場合、ラミブジン及びテノホビル ジソプロキシルフマル酸塩を含む抗HIV療法においてウイルス学的効果が得られないで、HIV-1逆転写酵素遺伝子M184V/I変異が認められた場合、ラミブジン及びテノホビル ジソプロキシルフマル酸塩を本剤に変更することのみで効果の改善は期待できない。
7.3. 〈治療〉腎機能障害のある患者では、エムトリシタビン製剤及びテノホビル ジソプロキシルフマル酸塩製剤の薬物動態試験において、エムトリシタビン及びテノホビルの血中濃度が上昇したとの報告があるので、腎機能の低下に応じて、次の投与方法を目安とする(外国人における薬物動態試験成績による)〔8.1、9.2.1、10.2、11.1.1、16.6.1参照〕[1)クレアチニンクリアランス(CLcr)50mL/min以上:本剤1錠を1日1回投与、2)クレアチニンクリアランス(CLcr)30~49mL/min:本剤1錠を2日間に1回投与、3)治療の場合、クレアチニンクリアランス<CLcr>30mL/min未満又は血液透析患者:本剤は投与しない]。
7.4. 〈治療〉核酸系逆転写酵素阻害薬(NRTI)3成分のみを用いる一部の治療は、NRTI2成分に非核酸系逆転写酵素阻害薬又はHIV-1プロテアーゼ阻害薬を併用する併用療法と比べて、概して効果が低いことが報告されているので、本剤と他のNRTI1成分のみによる治療で効果が認められない場合には他の組み合わせを考慮すること。
外形画像


改訂情報
2024年10月22日 DSU No.330 【その他】
【5.効能又は効果に関連する注意】(新設)
〈曝露前予防〉
本剤は、HIV-1感染症の曝露前予防に関する国内外のガイドライン等の最新の情報を参考に、HIV-1感染リスクの高い者における性的接触によるHIV-1感染の予防にのみ使用すること。
【5.効能又は効果に関連する注意】(新設)
本剤はHIV-1感染症を完全に予防できるとは限らない。本剤を使用する場合は、他のHIV-1感染予防手段(コンドームの使用、パートナーのHIV-1感染状態の把握、性感染症の定期的な検査等)と併用して使用すること。
【5.効能又は効果に関連する注意】(新設)
本剤単独ではHIV-1感染症に対する治療としては不十分であり、薬剤耐性変異を誘導する可能性があるため、本剤を使用する場合は、検査によりHIV-1陰性であることを確認すること。急性HIV-1感染症と一致する臨床症状がある場合は、本剤を投与しないこと。
【6.用法及び用量】(追記)
〈HIV-1感染症の曝露前予防〉
通常、成人には1回1錠(エムトリシタビンとして200mg及びテノホビルジソプロキシルフマル酸塩として300mgを含有)を1日1回経口投与する。
【7.用法及び用量に関連する注意】(削除)
本剤はエムトリシタビン及びテノホビルジソプロキシルフマル酸塩の固定用量を含有する配合剤であるので、エムトリシタビン又はテノホビルジソプロキシルフマル酸塩の個別の用法・用量の調節が必要な患者には、個別のエムトリシタビン製剤又はテノホビルジソプロキシルフマル酸塩製剤を用いること。
【7.用法及び用量に関連する注意】(一部改訂)
〈治療〉
腎機能障害のある患者では、エムトリシタビン製剤及びテノホビルジソプロキシルフマル酸塩製剤の薬物動態試験において、エムトリシタビン及びテノホビルの血中濃度が上昇したとの報告があるので、腎機能の低下に応じて、次の投与方法を目安とする(外国人における薬物動態試験成績による)。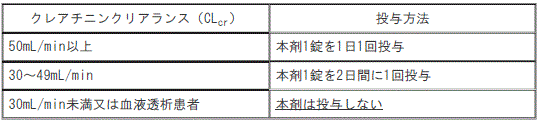
【8.重要な基本的注意】(削除)
本剤の有効成分であるエムトリシタビンの薬剤耐性を含むウイルス学的特性はラミブジンと類似しているので、本剤とラミブジンを含む製剤を併用しないこと。また、ラミブジン及びテノホビルジソプロキシルフマル酸塩を含む抗HIV療法においてウイルス学的効果が得られず、HIV-1逆転写酵素遺伝子のM184V/I変異が認められた場合、ラミブジン及びテノホビルジソプロキシルフマル酸塩を本剤に変更することのみで効果の改善は期待できない。
【8.重要な基本的注意】(追記)
〈曝露前予防〉
本剤を服用している間は、少なくとも3カ月ごとに、検査によりHIV-1陰性であることを確認すること。
【8.重要な基本的注意】(追記)
本剤によるHIV-1感染症の曝露前予防効果が認められているのは、1日1回連日投与した場合であるため、服用者に対して1日1回連日投与を遵守するよう指導すること。
【8.重要な基本的注意】(追記)
本剤の長期投与による影響については現在のところ不明である。
【9.2腎機能障害患者】(一部改訂)
中等度及び重度の腎機能障害のある患者:
〈効能共通〉
エムトリシタビン及びテノホビルの血中濃度が上昇する。
〈曝露前予防〉
クレアチニンクリアランスが60mL/min未満の者への投与は推奨されない。
医師の処方により使用する医薬品。
特定薬剤管理指導加算等の算定対象となる薬剤。



 で医薬品を比較する
で医薬品を比較する
