イミフィンジ点滴静注120mg
医療用
医療用医薬品:
医師の処方により使用する医薬品
医師の処方により使用する医薬品
- 収載区分
- 銘柄別収載
- 先発・後発情報
- 先発品(後発品なし)
- オーソライズド
ジェネリック - -
- 一般名
- デュルバルマブ(遺伝子組換え)注射液
- 英名(商品名)
- Imfinzi
- 規格
- 120mg2.4mL1瓶
- 薬価
- 67,871.00
- メーカー名
- アストラゼネカ
- 規制区分
- 劇薬
- 長期投与制限
- -
- 標榜薬効
- 抗悪性腫瘍薬〔ヒト型抗ヒトPD−L1モノクローナル抗体〕
- 色
- -
- 識別コード
- -
- [@: メーカーロゴ]
- 添付文書
-
PDF 2024年11月改訂(第7版)
- 告示日
- 2018年8月28日
- 経過措置期限
- -
- 医薬品マスタに反映
- 2018年9月版
- 医薬品マスタ削除予定
- -
- 運転注意
- 情報なし(使用の適否を判断するものではありません)
- ドーピング
- 禁止物質なし(使用の適否を判断するものではありません)
- CP換算
- -
- 長期収載品選定療養
- -
[識別コードの表記 @: メーカーロゴ]
効能効果
1). 切除不能な局所進行の非小細胞肺癌における根治的化学放射線療法後の維持療法。
2). 切除不能な進行・再発の非小細胞肺癌。
3). 進展型小細胞肺癌。
4). 切除不能な肝細胞癌。
5). 治癒切除不能な胆道癌。
6). 進行・再発の子宮体癌。
(効能又は効果に関連する注意)
5.1. 〈切除不能な局所進行の非小細胞肺癌における根治的化学放射線療法後の維持療法〉本剤の術後補助療法における有効性及び安全性は確立していない。
5.2. 〈切除不能な進行・再発の非小細胞肺癌〉本剤の術後補助療法における有効性及び安全性は確立していない。
5.3. 〈切除不能な進行・再発の非小細胞肺癌〉臨床試験に組み入れられた患者のEGFR遺伝子変異又はALK融合遺伝子の有無等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと〔17.1.2参照〕。
5.4. 〈進展型小細胞肺癌〉臨床試験に組み入れられた患者の進展型の基準等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと〔17.1.3参照〕。
5.5. 〈切除不能な肝細胞癌〉局所療法の適応となる肝細胞癌(経皮的エタノール注入療法の適応となる肝細胞癌、ラジオ波焼灼療法の適応となる肝細胞癌、マイクロ波凝固療法の適応となる肝細胞癌、肝動脈塞栓療法の適応となる肝細胞癌/肝動脈化学塞栓療法の適応となる肝細胞癌、放射線療法の適応となる肝細胞癌等)患者に対する本剤の有効性及び安全性は確立していない。
5.6. 〈切除不能な肝細胞癌〉臨床試験に組み入れられた患者の肝機能障害の程度等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと〔17.1.4参照〕。
5.7. 〈治癒切除不能な胆道癌〉本剤の術後補助療法における有効性及び安全性は確立していない。
5.8. 〈進行・再発の子宮体癌〉本剤の術後補助療法における有効性及び安全性は確立していない。
5.9. 〈進行・再発の子宮体癌〉臨床試験に組み入れられた患者の病期等について、「17.臨床成績」の項の内容を熟知した上で、適応患者の選択を行うこと〔17.1.6参照〕。
5.10. 〈進行・再発の子宮体癌〉本剤の有効性は、PD-L1発現状況により異なる傾向が示唆されているので、PD-L1発現状況別の有効性について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと〔17.1.6参照〕。
用法用量
〈切除不能な局所進行の非小細胞肺癌における根治的化学放射線療法後の維持療法〉
通常、成人にはデュルバルマブ(遺伝子組換え)として、1回1500mgを4週間間隔で60分間以上かけて点滴静注する。切除不能な局所進行の非小細胞肺癌における根治的化学放射線療法後の維持療法の場合、投与期間は12カ月間までとする。ただし、体重30kg以下の場合の1回投与量は20mg/kg(体重)とする。
〈切除不能な進行・再発の非小細胞肺癌〉
トレメリムマブ(遺伝子組換え)及び白金系抗悪性腫瘍剤を含む他の抗悪性腫瘍剤との併用において、通常、成人にはデュルバルマブ(遺伝子組換え)として、1回1500mgを3週間間隔で4回、60分間以上かけて点滴静注する。その後、デュルバルマブ(遺伝子組換え)として、1回1500mgを4週間間隔で60分間以上かけて点滴静注する。ただし、体重30kg以下の場合の1回投与量は20mg/kg(体重)とする。
〈進展型小細胞肺癌〉
白金系抗悪性腫瘍剤及びエトポシドとの併用において、通常、成人にはデュルバルマブ(遺伝子組換え)として、1回1500mgを3週間間隔で4回、60分間以上かけて点滴静注する。その後、デュルバルマブ(遺伝子組換え)として、1回1500mgを4週間間隔で60分間以上かけて点滴静注する。ただし、体重30kg以下の場合の1回投与量は20mg/kg(体重)とする。
〈切除不能な肝細胞癌〉
通常、成人にはデュルバルマブ(遺伝子組換え)として、1回1500mgを4週間間隔で60分間以上かけて点滴静注する。ただし、体重30kg以下の場合の1回投与量は20mg/kg(体重)とする。
〈治癒切除不能な胆道癌〉
ゲムシタビン塩酸塩及びシスプラチンとの併用において、通常、成人にはデュルバルマブ(遺伝子組換え)として、3週間間隔で、1回1500mgを60分間以上かけて点滴静注する。3週間間隔での繰り返し投与後、デュルバルマブ(遺伝子組換え)として、1回1500mgを4週間間隔で60分間以上かけて点滴静注する。ただし、体重30kg以下の場合の1回投与量は20mg/kg(体重)とする。
〈進行・再発の子宮体癌〉
カルボプラチン及びタキサン系抗悪性腫瘍剤との併用において、通常、成人にはデュルバルマブ(遺伝子組換え)として、1回1120mgを3週間間隔で、60分間以上かけて点滴静注する。その後の維持療法において、デュルバルマブ(遺伝子組換え)として、1回1500mgを4週間間隔で60分間以上かけて点滴静注する。ただし、体重30kg以下の場合、維持療法における1回投与量は、20mg/kg(体重)とする。
(用法及び用量に関連する注意)
7.1. 〈効能共通〉本剤投与により副作用が発現した場合には、次を参考に、本剤の休薬等を考慮すること。
1). 〈効能共通〉間質性肺疾患:
①. 〈効能共通〉Grade2の間質性肺疾患の場合:Grade1以下に回復するまで本剤を休薬する。
②. 〈効能共通〉Grade3の間質性肺疾患又はGrade4の間質性肺疾患の場合:本剤の投与を中止する。
2). 〈効能共通〉肝機能障害:
①. 〈効能共通〉ASTが基準値上限の3~10倍若しくはALTが基準値上限の3~10倍、又は総ビリルビンが基準値上限の1.5~3倍まで増加した場合:Grade1以下に回復するまで本剤を休薬する。
②. 〈効能共通〉ASTが基準値上限の10倍超若しくはALTが基準値上限の10倍超、又は総ビリルビンが基準値上限の3倍超まで増加した場合:本剤の投与を中止する。
③. 〈効能共通〉ASTが基準値上限の3倍超かつ総ビリルビンが基準値上限の2倍超若しくはALTが基準値上限の3倍超かつ総ビリルビンが基準値上限の2倍超まで増加し、本剤以外に原因がない場合:本剤の投与を中止する。
3). 〈効能共通〉肝機能障害(ベースラインのAST若しくはALTが基準値上限を超えている肝悪性腫瘍を有する患者):
①. 〈効能共通〉ASTがベースラインの2.5~7倍かつ基準値上限の20倍以下若しくはALTがベースラインの2.5~7倍かつ基準値上限の20倍以下(ベースラインのASTが基準値上限を超えている肝悪性腫瘍若しくはベースラインのALTが基準値上限を超えている肝悪性腫瘍を有する患者)に増加した場合:ベースラインの2.5倍未満に回復するまで本剤を休薬する。
②. 〈効能共通〉ASTがBS2.5~5倍でULN20倍以下・総BilがULN1.5~2倍若しくはALTがBS2.5~5倍でULN20倍以下・総BilがULN1.5~2倍(ベースラインのASTが基準値上限を超えている肝悪性腫瘍若しくはベースラインのALTが基準値上限を超えている肝悪性腫瘍を有する患者)に増加し、本剤以外に原因がない場合:ベースラインの2.5倍未満に回復するまで本剤を休薬する(BS:ベースライン、ULN:基準値上限、Bil:ビリルビン)。
③. 〈効能共通〉ASTがベースラインの7倍超若しくはALTがベースラインの7倍超、又はASTが基準値上限の20倍超若しくはALTが基準値上限の20倍超、総ビリルビンが基準値上限の3倍超(ベースラインのASTが基準値上限を超えている肝悪性腫瘍若しくはベースラインのALTが基準値上限を超えている肝悪性腫瘍を有する患者)まで増加した場合:本剤の投与を中止する。
④. 〈効能共通〉ASTがベースラインの2.5倍超かつ総ビリルビンが基準値上限の2倍超若しくはALTがベースラインの2.5倍超かつ総ビリルビンが基準値上限の2倍超(ベースラインのASTが基準値上限を超えている肝悪性腫瘍若しくはベースラインのALTが基準値上限を超えている肝悪性腫瘍を有する患者)まで増加し、本剤以外に原因がない場合:本剤の投与を中止する。
4). 〈効能共通〉大腸炎・下痢:
①. 〈効能共通〉Grade2の大腸炎・Grade2の下痢の場合:Grade1以下に回復するまで本剤を休薬する。
②. 〈効能共通〉Grade3の大腸炎・Grade3の下痢の場合:Grade1以下に回復するまで本剤を休薬する。
③. 〈効能共通〉Grade3の大腸炎・Grade3の下痢の場合:トレメリムマブ(遺伝子組換え)との併用の場合は、本剤の投与を中止する。
④. 〈効能共通〉Grade4の大腸炎・Grade4の下痢の場合:本剤の投与を中止する。
5). 〈効能共通〉消化管穿孔:全Grade:本剤の投与を中止する。
6). 〈効能共通〉甲状腺機能亢進症、副腎機能不全、下垂体機能低下症:Grade2~4の甲状腺機能亢進症、Grade2~4の副腎機能不全、Grade2~4の下垂体機能低下症の場合:症状が安定するまで本剤を休薬する。
7). 〈効能共通〉腎機能障害:
①. 〈効能共通〉血清クレアチニンが基準値上限の1.5~3倍又は血清クレアチニンがベースラインの1.5~3倍まで増加した場合:Grade1以下に回復するまで本剤を休薬する。
②. 〈効能共通〉血清クレアチニンが基準値上限の3倍超又は血清クレアチニンがベースラインの3倍超まで増加した場合:本剤の投与を中止する。
8). 〈効能共通〉筋炎:
①. 〈効能共通〉Grade2の筋炎又はGrade3の筋炎の場合:Grade1以下に回復するまで本剤を休薬し、30日以内にGrade1以下まで回復しない場合又は呼吸機能不全の徴候があらわれた場合は、本剤の投与を中止する。
②. 〈効能共通〉Grade4の筋炎の場合:本剤の投与を中止する。
9). 〈効能共通〉心筋炎:Grade2~4の心筋炎の場合:本剤の投与を中止する。
10). 〈効能共通〉重症筋無力症:Grade2~4の重症筋無力症の場合:本剤の投与を中止する。
11). 〈効能共通〉脳炎:Grade2~4の脳炎の場合:本剤の投与を中止する。
12). 〈効能共通〉神経障害:
①. 〈効能共通〉Grade2の神経障害の場合:Grade1以下に回復するまで本剤を休薬し、30日以内にGrade1以下まで回復しない場合又は呼吸機能不全の徴候があらわれた場合は、本剤の投与を中止する。
②. 〈効能共通〉Grade3の神経障害又はGrade4の神経障害の場合、Grade2~4のギラン・バレー症候群の場合:本剤の投与を中止する。
13). 〈効能共通〉皮膚障害:
①. 〈効能共通〉Grade2の皮膚障害で1週間以上継続した場合、Grade3の皮膚障害の場合:Grade1以下に回復するまで本剤を休薬する。
②. 〈効能共通〉Grade4の皮膚障害の場合、皮膚粘膜眼症候群(Stevens-Johnson症候群)又は中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)の場合:本剤の投与を中止する。
14). 〈効能共通〉Infusion reaction:
①. 〈効能共通〉Grade1のInfusion reaction又はGrade2のInfusion reactionの場合:本剤の投与を中断又は投与速度を50%減速する。
②. 〈効能共通〉Grade3のInfusion reaction又はGrade4のInfusion reactionの場合:本剤の投与を中止する。
15). 〈効能共通〉赤芽球癆:全Grade:本剤の投与を中止する。
16). 〈効能共通〉オラパリブとの併用投与下の自己免疫性溶血性貧血:全Grade:本剤及びオラパリブの投与を中止する。
17). 〈効能共通〉前記以外の副作用(甲状腺機能低下症、1型糖尿病を除く):
①. 〈効能共通〉Grade2の副作用<甲状腺機能低下症・1型糖尿病を除く>又はGrade3の副作用<甲状腺機能低下症・1型糖尿病を除く>の場合:Grade1以下に回復するまで本剤を休薬する。
②. 〈効能共通〉Grade4の副作用<甲状腺機能低下症・1型糖尿病を除く>の場合:本剤の投与を中止する。
GradeはNCI-CTCAE(Common Terminology Criteria for Adverse Events)v4.03に準じる。
7.2. 〈切除不能な局所進行の非小細胞肺癌における根治的化学放射線療法後の維持療法〉他の抗悪性腫瘍剤との併用について、有効性及び安全性は確立していない。
7.3. 〈切除不能な進行・再発の非小細胞肺癌〉併用する他の抗悪性腫瘍剤は、「17.臨床成績」の項の内容を熟知し選択すること〔17.1.2参照〕。
7.4. 〈切除不能な肝細胞癌〉本剤の用法及び用量は「17.臨床成績」の項の内容を熟知し、併用投与及び単独投与の有効性及び安全性を十分に理解した上で、選択すること〔17.1.4参照〕。
7.5. 〈進行・再発の子宮体癌〉カルボプラチン及びパクリタキセルとの併用において投与を開始すること。
改訂情報
2025年1月6日 DSU No.332 【その他】
【5.効能又は効果に関連する注意】(追記)
〈進行・再発の子宮体癌〉
本剤の術後補助療法における有効性及び安全性は確立していない。
【5.効能又は効果に関連する注意】(追記)
臨床試験に組み入れられた患者の病期等について、「17.臨床成績」の項の内容を熟知した上で、適応患者の選択を行うこと。
【5.効能又は効果に関連する注意】(追記)
本剤の有効性は、PD-L1発現状況により異なる傾向が示唆されている。PD-L1発現状況別の有効性について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。
【6.用法及び用量】(追記)
〈進行・再発の子宮体癌〉
カルボプラチン及びタキサン系抗悪性腫瘍剤との併用において、通常、成人にはデュルバルマブ(遺伝子組換え)として、1回1120mgを3週間間隔で、60分間以上かけて点滴静注する。その後の維持療法において、デュルバルマブ(遺伝子組換え)として、1回1500mgを4週間間隔で60分間以上かけて点滴静注する。ただし、体重30kg以下の場合、維持療法における1回投与量は、20mg/kg(体重)とする。
【7.用法及び用量に関連する注意】(一部改訂)
〈効能共通〉
本剤投与により副作用が発現した場合には、下表を参考に、本剤の休薬等を考慮すること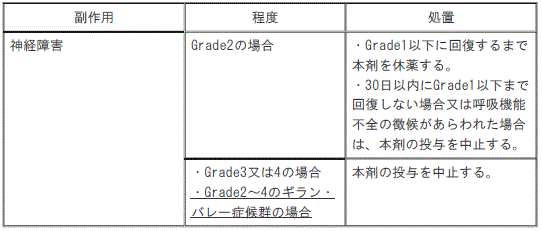
【7.用法及び用量に関連する注意】(追記)
【7.用法及び用量に関連する注意】(追記)
〈進行・再発の子宮体癌〉
カルボプラチン及びパクリタキセルとの併用において投与を開始すること。
【9.4生殖能を有する者】(一部改訂)
妊娠する可能性のある女性には、本剤投与中及び最終投与後3カ月間において避妊する必要性及び適切な避妊法について説明すること。
【11.1重大な副作用】(一部改訂)
1型糖尿病:
1型糖尿病(劇症1型糖尿病を含む)があらわれ、糖尿病性ケトアシドーシスに至るおそれがある。1型糖尿病が疑われた場合には、インスリン製剤を投与する等の適切な処置を行うこと。
【11.1重大な副作用】(追記)
赤芽球癆:
本剤とオラパリブとの併用において、赤芽球癆があらわれることがある。
【11.1重大な副作用】(追記)
溶血性貧血:
本剤とオラパリブとの併用において、溶血性貧血があらわれることがある。
【11.2その他の副作用】(一部改訂)
類似した薬効の薬
よく一緒に見られている薬
医師の処方により使用する医薬品。
特定薬剤管理指導加算等の算定対象となる薬剤。



 で医薬品を比較する
で医薬品を比較する
