ニンラーロカプセル2.3mg
医療用
医療用医薬品:
医師の処方により使用する医薬品
医師の処方により使用する医薬品
- 収載区分
- 銘柄別収載
- 先発・後発情報
- 先発品(後発品なし)
- オーソライズド
ジェネリック - -
- 一般名
- イキサゾミブクエン酸エステルカプセル
- 英名(商品名)
- Ninlaro
- 規格
- 2.3mg1カプセル
- 薬価
- 98,306.40
- メーカー名
- 武田薬品
- 規制区分
- 毒薬
- 長期投与制限
- -
- 標榜薬効
- 抗悪性腫瘍薬〔プロテアソーム阻害薬〕
- 色
- 微赤:微赤
- 識別コード
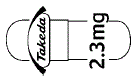
- (本体)@ 2.3mg (本体)Takeda 2.3mg (被包)NINLARO capsules 2.3mg. (被包)NINLARO 2.3mg @ 2.3mg (被包)NINLARO 2.3mg Takeda 2.3mg
- [@: メーカーロゴ]
- 添付文書
-
PDF 2024年8月改訂(第5版)
- 告示日
- 2017年5月23日
- 経過措置期限
- -
- 医薬品マスタに反映
- 2017年6月版
- DIRに反映
- 2017年6月版
- DIR削除予定
- -
- 運転注意
- 情報なし(使用の適否を判断するものではありません)
- ドーピング
- 禁止物質なし(使用の適否を判断するものではありません)
- CP換算
- -
- 長期収載品選定療養
- -
[識別コードの表記 @: メーカーロゴ]
効能効果
1). 再発又は難治性の多発性骨髄腫。
2). 多発性骨髄腫における維持療法。
(効能又は効果に関連する注意)
5.1. 〈再発又は難治性の多発性骨髄腫〉本剤による治療は、少なくとも1つの標準的な治療が無効又は治療後に再発した患者を対象とすること。
5.2. 〈再発又は難治性の多発性骨髄腫〉臨床試験に組み入れられた患者の前治療歴等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分理解した上で、適応患者の選択を行うこと〔17.1.1参照〕。
用法用量
〈再発又は難治性の多発性骨髄腫〉
レナリドミド及びデキサメタゾンとの併用において、通常、成人にはイキサゾミブとして1日1回4mgを空腹時に週1回、3週間(1、8及び15日目)経口投与した後、13日間休薬(16~28日目)する。この4週間を1サイクルとし、投与を繰り返す。なお、患者の状態により適宜減量する。
〈多発性骨髄腫における維持療法〉
通常、成人には1日1回、本剤を空腹時に週1回、3週間(1、8及び15日目)経口投与した後、13日間休薬(16~28日目)する。この4週間を1サイクルとし、投与を繰り返す。本剤の投与量は、4サイクルまではイキサゾミブとして3mg、5サイクル以降はイキサゾミブとして4mgとする。なお、患者の状態により適宜減量する。
(用法及び用量に関連する注意)
7.1. 〈効能共通〉食後に本剤を投与した場合、本剤のCmax低下及びAUC低下するとの報告がある。食事の影響を避けるため、食事の1時間前から食後2時間までの間の服用は避けること〔16.2.1参照〕。
7.2. 〈効能共通〉新たなサイクルの開始にあたっては、次の基準を参考に投与の可否を判断すること。
[サイクル開始基準]
1). 好中球数:1000/mm3以上。
2). 血小板数:75000/mm3以上。
3). 非血液毒性:ベースライン又はGrade1以下に回復。
GradeはNCI-CTCAE v4.0に基づく。
7.3. 〈再発又は難治性の多発性骨髄腫〉本剤を単独投与した場合の有効性及び安全性は確立していない。
7.4. 〈再発又は難治性の多発性骨髄腫〉レナリドミド及びデキサメタゾンの投与に際しては、「17.臨床成績」の項の内容を熟知し、投与すること〔17.1.1参照〕。
7.5. 〈再発又は難治性の多発性骨髄腫〉レナリドミド及びデキサメタゾン以外の抗悪性腫瘍剤との併用における有効性及び安全性は確立していない。
7.6. 〈再発又は難治性の多発性骨髄腫〉本剤投与により副作用が発現した場合には、次の基準を参考に、本剤を休薬、減量、中止すること〔8.重要な基本的注意の項、11.1.1、11.1.4参照〕。
[本剤の減量ステップ]
1). 〈再発又は難治性の多発性骨髄腫〉開始用量:4mg。
2). 〈再発又は難治性の多発性骨髄腫〉ステップ1(1段階減量):3mg。
3). 〈再発又は難治性の多発性骨髄腫〉ステップ2(2段階減量):2.3mg。
4). 〈再発又は難治性の多発性骨髄腫〉ステップ3:投与中止。
[休薬・減量・中止基準]
1). 〈再発又は難治性の多発性骨髄腫〉血小板減少症:血小板数30000/mm3未満;30000/mm3以上に回復するまで、休薬し、回復後、同一用量で投与を再開できる(再び30000/mm3未満に減少した場合は、30000/mm3以上に回復するまで、休薬し、回復後、1段階減量して投与を再開できる)。
2). 〈再発又は難治性の多発性骨髄腫〉好中球減少症:好中球数500/mm3未満;500/mm3以上に回復するまで、休薬し、回復後、同一用量で投与を再開できる(再び500/mm3未満に減少した場合は、500/mm3以上に回復するまで、休薬し、回復後、1段階減量して投与を再開できる)。
3). 皮膚障害:
①. 〈再発又は難治性の多発性骨髄腫〉Grade2の皮膚障害;対症療法を行い、投与を継続できる(忍容できない場合は、Grade1以下に回復するまで、休薬し、回復後、1段階減量して投与を再開できる)。
②. 〈再発又は難治性の多発性骨髄腫〉Grade3の皮膚障害;Grade1以下に回復するまで、休薬し、回復後、1段階減量して投与を再開できる。
③. 〈再発又は難治性の多発性骨髄腫〉Grade4の皮膚障害;投与を中止する。
4). 末梢神経障害:
①. 〈再発又は難治性の多発性骨髄腫〉疼痛を伴うGrade1の末梢神経障害又は疼痛を伴わないGrade2の末梢神経障害;ベースライン又は疼痛を伴わないGrade1以下に回復するまで、休薬し、回復後、同一用量で投与を再開できる。
②. 〈再発又は難治性の多発性骨髄腫〉疼痛を伴うGrade2の末梢神経障害又はGrade3の末梢神経障害;ベースライン又はGrade1以下に回復するまで、休薬し、回復後、1段階減量して投与を再開できる。
③. 〈再発又は難治性の多発性骨髄腫〉Grade4の末梢神経障害;投与を中止する。
5). 前記以外の副作用:
①. 〈再発又は難治性の多発性骨髄腫〉Grade3の非血液毒性;ベースライン又はGrade1以下に回復するまで、休薬し、回復後、1段階減量して投与を再開できる。
②. 〈再発又は難治性の多発性骨髄腫〉Grade4の非血液毒性;投与を中止する。
GradeはNCI-CTCAE v4.0に基づく。
7.7. 〈多発性骨髄腫における維持療法〉他の抗悪性腫瘍剤との併用における有効性及び安全性は確立していない。
7.8. 〈多発性骨髄腫における維持療法〉本剤を24ヵ月を超えて投与した場合の有効性及び安全性は確立していない。
7.9. 〈多発性骨髄腫における維持療法〉本剤投与により副作用が発現した場合には、次の基準を参考に、本剤を休薬、減量、中止すること〔8.重要な基本的注意の項、11.1.1、11.1.4参照〕。
[本剤の減量ステップ]
1). 〈多発性骨髄腫における維持療法〉通常用量:1~4サイクル3mg、5サイクル以降4mg。
2). 〈多発性骨髄腫における維持療法〉ステップ1(1段階減量):1~4サイクル2.3mg、5サイクル以降3mg。
3). 〈多発性骨髄腫における維持療法〉ステップ2(2段階減量):1~4サイクル1.5mg、5サイクル以降2.3mg。
4). 〈多発性骨髄腫における維持療法〉ステップ3(3段階減量):1~4サイクル投与中止、5サイクル以降1.5mg。
5). 〈多発性骨髄腫における維持療法〉ステップ4:5サイクル以降投与中止。
[休薬・減量・中止基準]
1). 〈多発性骨髄腫における維持療法〉血小板減少症:血小板数50000/mm3未満;75000/mm3以上に回復するまで、休薬し、回復後、1段階減量して投与を再開できる。
2). 〈多発性骨髄腫における維持療法〉好中球減少症:好中球数750/mm3未満;1000/mm3以上に回復するまで、休薬し、回復後、1段階減量して投与を再開できる。
3). 皮膚障害:
①. 〈多発性骨髄腫における維持療法〉Grade2の皮膚障害;対症療法を行い、投与を継続できる(忍容できない場合は、1段階減量して投与する)。
②. 〈多発性骨髄腫における維持療法〉Grade3の皮膚障害;Grade1以下に回復するまで、休薬し、回復後、1段階減量して投与を再開できる。
③. 〈多発性骨髄腫における維持療法〉Grade4の皮膚障害;投与を中止する。
4). 末梢神経障害:
①. 〈多発性骨髄腫における維持療法〉疼痛を伴うGrade1の末梢神経障害又は疼痛を伴わないGrade2の末梢神経障害;ベースライン又は疼痛を伴わないGrade1以下に回復するまで、休薬し、回復後、同一用量で投与を再開できる。
②. 〈多発性骨髄腫における維持療法〉疼痛を伴うGrade2の末梢神経障害又はGrade3の末梢神経障害;ベースライン又はGrade1以下に回復するまで、休薬し、回復後、1段階減量して投与を再開できる。
③. 〈多発性骨髄腫における維持療法〉Grade4の末梢神経障害;投与を中止する。
5). 前記以外の副作用:
①. 〈多発性骨髄腫における維持療法〉Grade3の非血液毒性;ベースライン又はGrade1以下に回復するまで、休薬し、回復後、1段階減量して投与を再開できる。
②. 〈多発性骨髄腫における維持療法〉Grade4の非血液毒性;投与を中止する、又は治療上の有益性を考慮し、1段階減量して投与を再開できる。
GradeはNCI-CTCAE v4.0に基づく。
7.10. 〈多発性骨髄腫における維持療法〉0.5mgカプセルと他の含量のカプセルの生物学的同等性は示されていないため、3mg又は4mgを投与する際には0.5mgカプセルを使用しないこと。
外形画像
改訂情報
2024年10月22日 DSU No.330 【その他】
【7.用法及び用量に関連する注意】(一部改訂)
〈多発性骨髄腫における維持療法〉
本剤投与により副作用が発現した場合には、以下の基準を参考に、本剤を休薬、減量、中止すること。
本剤の減量ステップ
【7.用法及び用量に関連する注意】(追記)
0.5mgカプセルと他の含量のカプセルの生物学的同等性は示されていないため、3mg又は4mgを投与する際には0.5mgカプセルを使用しないこと。
2024年6月25日 DSU No.327 【その他】
【11.2その他の副作用】(追記)
医師の処方により使用する医薬品。
特定薬剤管理指導加算等の算定対象となる薬剤。


