イブランスカプセル25mg
医療用
医療用医薬品:
医師の処方により使用する医薬品
医師の処方により使用する医薬品
- 収載区分
- 銘柄別収載
- 先発・後発情報
- 先発品(後発品なし)
- オーソライズド
ジェネリック - -
- 一般名
- パルボシクリブカプセル
- 英名(商品名)
- Ibrance
- 規格
- 25mg1カプセル
- 薬価
- 5,076.80
- メーカー名
- ファイザー
- 規制区分
- 劇薬
- 長期投与制限
- -
- 標榜薬効
- 抗悪性腫瘍薬〔サイクリン依存性キナーゼ(CDK)4/6阻害薬〕
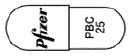
- 色
- 赤褐:灰
- 識別コード
- (本体)@ PBC 25 (本体)Pfizer PBC 25 (被包)@ 25mg (被包)Pfizer 25mg (被包)IBRANCE @ PBC 25 (被包)IBRANCE Pfizer PBC 25
- [@: メーカーロゴ]
- 添付文書
-
PDF 2024年12月改訂(第4版)
- 告示日
- 2017年11月21日
- 経過措置期限
- 2024年3月31日
- 医薬品マスタに反映
- 2017年12月版
- 医薬品マスタ削除予定
- 2025年10月版
- 運転注意
- 情報なし(使用の適否を判断するものではありません)
- ドーピング
- 禁止物質なし(使用の適否を判断するものではありません)
- CP換算
- -
- 長期収載品選定療養
- -
[識別コードの表記 @: メーカーロゴ]
効能効果
手術不能又は再発乳癌。
(効能又は効果に関連する注意)
5.1. 本剤の術前・術後薬物療法としての有効性及び安全性は確立していない。
5.2. 本剤の投与を行う場合には、ホルモン受容体陽性、HER2陰性の患者を対象とすること。
用法用量
内分泌療法剤との併用において、通常、成人にはパルボシクリブとして1日1回125mgを3週間連続して食後に経口投与し、その後1週間休薬する。これを1サイクルとして投与を繰り返す。なお、患者の状態により適宜減量する。
(用法及び用量に関連する注意)
7.1. 併用する内分泌療法剤等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、選択を行うこと〔17.1.1-17.1.3参照〕。
7.2. 副作用があらわれた場合は、次の基準を考慮して、休薬、減量又は投与を中止すること。なお、本剤は75mg/日未満に減量しないこと。
[減量して投与を継続する場合の投与量]
1). 通常投与量:125mg/日。
2). 一次減量:100mg/日。
3). 二次減量:75mg/日。
[好中球減少症及び血小板減少症に対する用量調節]
1). Grade1の好中球減少症及びGrade1の血小板減少症又はGrade2の好中球減少症及びGrade2の血小板減少症:同一投与量を継続する。
2). Grade3の好中球減少症及びGrade3の血小板減少症:
①. Grade3の好中球減少症:休薬し、1週間以内に血液検査(血球数算定)を行い、Grade2以下に回復後、同一投与量で投与を再開する(Grade3の好中球減少の回復に日数を要する場合(1週間以上)や次サイクルでGrade3の好中球減少が再発する場合は、減量を考慮すること)。
②. Grade3の血小板減少症:休薬し、1週間以内に血液検査(血球数算定)を行い、Grade2以下に回復後、同一投与量で投与を再開する。
3). Grade3の好中球減少症<好中球減少に付随して38.5℃以上の発熱>又はGrade3の好中球減少症<好中球減少に付随して感染症>がある場合:Grade2以下に回復するまで休薬し、回復後、1レベル減量し投与を再開する。
4). Grade4の好中球減少症及びGrade4の血小板減少症:Grade2以下に回復するまで休薬し、回復後、1レベル減量し投与を再開する。
GradeはCTCAE ver.4.0に準ずる。
[非血液系の副作用に対する用量調節]
1). Grade1の非血液系副作用又はGrade2の非血液系副作用:同一投与量を継続する。
2). Grade3以上の非血液系副作用<治療しても症状が継続>する場合:Grade1以下又はGrade2で安全性に問題がない状態に回復するまで休薬し、回復後、1レベル減量し投与を再開する。
GradeはCTCAE ver.4.0に準ずる。
外形画像
改訂情報
2025年1月6日 DSU No.332 【その他】
【11.2その他の副作用】(一部改訂)
医師の処方により使用する医薬品。
特定薬剤管理指導加算等の算定対象となる薬剤。




