メキニスト錠2mg
医療用
医療用医薬品:
医師の処方により使用する医薬品
医師の処方により使用する医薬品
- 収載区分
- 銘柄別収載
- 先発・後発情報
- 先発品(後発品なし)
- オーソライズド
ジェネリック - -
- 一般名
- トラメチニブ ジメチルスルホキシド付加物錠
- 英名(商品名)
- Mekinist
- 規格
- 2mg1錠
- 薬価
- 29,558.40
- メーカー名
- ノバルティス ファーマ
- 規制区分
- 劇薬
- 長期投与制限
- -
- 標榜薬効
- 抗悪性腫瘍薬〔MEK阻害薬〕
- 色
- 淡紅
- 識別コード
- (本体)@ (本体)LL
- [@: メーカーロゴ]
- 添付文書
-
PDF 2024年9月改訂(第5版)
- 告示日
- 2016年5月24日
- 経過措置期限
- -
- 医薬品マスタに反映
- 2016年6月版
- DIRに反映
- 2016年6月版
- DIR削除予定
- -
- 運転注意
- 情報なし(使用の適否を判断するものではありません)
- ドーピング
- 禁止物質なし(使用の適否を判断するものではありません)
- CP換算
- -
- 長期収載品選定療養
- -
[識別コードの表記 @: メーカーロゴ]
効能効果
1). BRAF遺伝子変異を有する悪性黒色腫。
2). BRAF遺伝子変異を有する切除不能な進行・再発の非小細胞肺癌。
3). 標準的な治療が困難なBRAF遺伝子変異を有する進行・再発の固形腫瘍<結腸・直腸癌を除く>。
4). BRAF遺伝子変異を有する再発又は難治性の有毛細胞白血病。
5). BRAF遺伝子変異を有する低悪性度神経膠腫。
(効能又は効果に関連する注意)
5.1. 〈効能共通〉十分な経験を有する病理医又は検査施設における検査により、BRAF遺伝子変異が確認された患者に投与すること(検査にあたっては、承認された体外診断用医薬品又は医療機器を用いること)。なお、承認された体外診断用医薬品又は医療機器に関する情報については、次のウェブサイトから入手可能である:
https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html。
5.2. 〈悪性黒色腫〉「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で適応患者の選択を行うこと〔17.1.1-17.1.4参照〕。
5.3. 〈非小細胞肺癌〉「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で適応患者の選択を行うこと〔17.1.5参照〕。
5.4. 〈非小細胞肺癌〉本剤の術後補助療法における有効性及び安全性は確立していない。
5.5. 〈固形腫瘍〉組織球症患者は本剤の投与対象となり得る。
5.6. 〈固形腫瘍〉臨床試験に組み入れられた患者のがん種等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、本剤以外の治療の実施についても慎重に検討し、適応患者の選択を行うこと〔17.1.6-17.1.8参照〕。
5.7. 〈固形腫瘍〉1歳未満の患者における有効性及び安全性は確立していない〔9.7小児等の項、17.1.8参照〕。
5.8. 〈固形腫瘍〉本剤の手術の補助療法における有効性及び安全性は確立していない。
5.9. 〈有毛細胞白血病〉臨床試験に組み入れられた患者の前治療歴等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと〔17.1.6参照〕。
5.10. 〈低悪性度神経膠腫〉臨床試験に組み入れられた患者の年齢、病理組織型等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で適応患者の選択を行うこと〔17.1.9参照〕。
5.11. 〈低悪性度神経膠腫〉1歳未満の患者における有効性及び安全性は確立していない〔9.7小児等の項、17.1.9参照〕。
5.12. 〈低悪性度神経膠腫〉切除後に疾患進行した又は切除が困難な患者を対象とすること〔17.1.9参照〕。
用法用量
〈悪性黒色腫〉
ダブラフェニブとの併用において、通常、成人にはトラメチニブとして2mgを1日1回、空腹時に経口投与する。ただし、悪性黒色腫で術後補助療法の場合には、投与期間は12ヵ月間までとする。なお、患者の状態により適宜減量する。
〈非小細胞肺癌、有毛細胞白血病〉
ダブラフェニブとの併用において、通常、成人にはトラメチニブとして2mgを1日1回、空腹時に経口投与する。なお、患者の状態により適宜減量する。
〈固形腫瘍、低悪性度神経膠腫〉
ダブラフェニブとの併用において、通常、トラメチニブとして次の用量を1日1回、空腹時に経口投与する。なお、患者の状態により適宜減量する。
・ 成人には、2mg。
・ 小児には、体重に合わせて次の用量。
1). 体重26kg以上38kg未満:1mg。
2). 体重38kg以上51kg未満:1.5mg。
3). 体重51kg以上:2mg。
(用法及び用量に関連する注意)
7.1. 〈効能共通〉食後に本剤を投与した場合、Cmax低下及びAUC低下するとの報告がある。食事の影響を避けるため、食事の1時間前から食後2時間までの間の服用は避けること〔16.2.1参照〕。
7.2. 〈効能共通〉本剤投与により副作用(発熱を除く)が発現した場合には、次記の基準を参考に、本剤を休薬、減量又は中止すること。ただし、有棘細胞癌(皮膚扁平上皮癌)又は新たな原発性悪性黒色腫が発現した場合には、外科的切除等の適切な処置を行った上で、休薬、減量することなく治療を継続することができる〔7.3参照〕。
[休薬、減量及び中止基準]
1). NCI-CTCAE*によるGrade判定が、忍容不能なGrade2又はGrade3:休薬、Grade1以下まで軽快後、1段階減量して投与を再開。
2). NCI-CTCAE*によるGrade判定が、Grade4:原則投与中止、治療継続が患者にとって望ましいと判断された場合には、Grade1以下まで軽快後、1段階減量して投与を再開。
*)NCI-CTCAE v4.0によりGradeを判定。
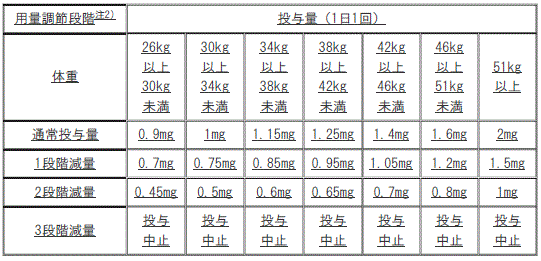
[用量調節の目安(成人)]
1). 通常投与量:2mg(1日1回)。
2). 1段階減量:1.5mg(1日1回)。
3). 2段階減量:1mg(1日1回)。
4). 3段階減量:投与中止。
[用量調節の目安(小児)]
1). 通常投与量:1mg(1日1回):
①. 1段階減量:0.5mg(1日1回)。
②. 2段階減量:投与中止。
2). 通常投与量:1.5mg(1日1回):
①. 1段階減量:1mg(1日1回)。
②. 2段階減量:0.5mg(1日1回)。
③. 3段階減量:投与中止。
3). 通常投与量:2mg(1日1回):
①. 1段階減量:1.5mg(1日1回)。
②. 2段階減量:1mg(1日1回)。
③. 3段階減量:投与中止。
適切な処置により副作用が管理できた場合には、減量時と逆の段階を経て増量可。
7.3. 〈効能共通〉38.0℃以上の発熱が認められた場合には、本剤を休薬すること(発熱の回復後、24時間以上発熱がない場合には、休薬前と同一の用量で投与を再開すること)、38.0℃未満の発熱又は悪寒、戦慄、寝汗、インフルエンザ様症状等の発熱の初期症状の再発が認められた時点で本剤の休薬を検討すること(必要に応じて、7.2項の用量調節の目安を参考に、本剤を減量すること(本剤を休薬しても4週間以内に発熱がGrade1以下又はベースラインに軽快しない場合は、本剤の投与を中止すること))〔7.2、8.4参照〕。
7.4. 〈効能共通〉0.5mg錠と2mg錠の生物学的同等性は示されていないため、2mgを投与する際には0.5mg錠を使用しないこと。
7.5. 〈固形腫瘍、低悪性度神経膠腫〉8kg未満の小児患者における有効性及び安全性は確立していない。
7.6. 〈固形腫瘍、低悪性度神経膠腫〉錠と小児用ドライシロップの生物学的同等性は示されていない(錠と小児用ドライシロップの切替えを行う場合は、患者の状態をより慎重に観察すること)。
外形画像



改訂情報
2024年10月22日 DSU No.330 【その他】
【5.効能又は効果に関連する注意】(追記)
〈固形腫瘍〉
1歳未満の患者における有効性及び安全性は確立していない。
【5.効能又は効果に関連する注意】(追記)
〈低悪性度神経膠腫〉
臨床試験に組み入れられた患者の年齢、病理組織型等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で適応患者の選択を行うこと。
【5.効能又は効果に関連する注意】(追記)
1歳未満の患者における有効性及び安全性は確立していない。
【5.効能又は効果に関連する注意】(追記)
切除後に疾患進行した又は切除が困難な患者を対象とすること。
【6.用法及び用量】(一部改訂)
〈錠〉
〈固形腫瘍、低悪性度神経膠腫〉
ダブラフェニブとの併用において、通常、トラメチニブとして以下の用量を1日1回、空腹時に経口投与する。なお、患者の状態により適宜減量する。
・成人には、2mg
・小児には、体重に合わせて次の用量
【6.用法及び用量】(追記)
〈小児用ドライシロップ〉
〈固形腫瘍、低悪性度神経膠腫〉
ダブラフェニブとの併用において、通常、小児にはトラメチニブとして体重に合わせて次の用量を1日1回、空腹時に経口投与する。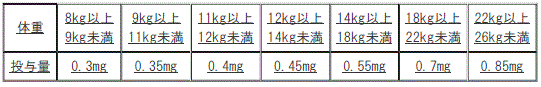

【7.用法及び用量に関連する注意】(追記)
〈効能共通〉
〈小児用ドライシロップの場合〉
用量調節の目安(小児)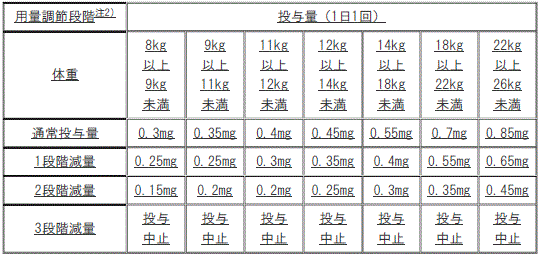
【7.用法及び用量に関連する注意】(一部改訂)
〈固形腫瘍、低悪性度神経膠腫〉
8kg未満の小児患者における有効性及び安全性は確立していない。
【7.用法及び用量に関連する注意】(追記)
錠と小児用ドライシロップの生物学的同等性は示されていない。錠と小児用ドライシロップの切替えを行う場合は、患者の状態をより慎重に観察すること。
【9.7小児等】(一部改訂)
〈固形腫瘍、低悪性度神経膠腫〉
低出生体重児、新生児を対象とした臨床試験は実施していない。
【11.2その他の副作用】(一部改訂)
〈ダブラフェニブとの併用時〉
【14.適用上の注意】(新設)
〈小児用ドライシロップ〉
[薬剤交付時の注意]
患者又は保護者等に対して具体的な調製方法、投与時の注意点等を指導すること。
【14.適用上の注意】(新設)
[薬剤調製時の注意]
容器のラベルに記載されている目印まで水を入れた後、静かに転倒混和してシロップ剤を調製すること。なお、調製後のシロップ剤はトラメチニブとして0.05mg/mLの溶液となる。
【14.適用上の注意】(新設)
調製後のシロップ剤は、25℃以下で遮光保存し、凍結させないこと。調製後のシロップ剤は、使用の都度密栓し、調製日から35日以内に使用すること。調製から35日を経過した場合は、シロップ剤を廃棄すること。
2024年4月11日 DSU No.325 【その他】
【7.用法及び用量に関連する注意】(一部改訂)
【新様式】
〈効能共通〉
本剤投与により副作用(発熱を除く)が発現した場合には、下記の基準を参考に、本剤を休薬、減量又は中止すること。ただし、有棘細胞癌(皮膚の扁平上皮癌)又は新たな原発性悪性黒色腫が発現した場合には、外科的切除等の適切な処置を行った上で、休薬、減量することなく治療を継続することができる。
【7.用法及び用量に関連する注意】(追記)
【新様式】
38.0℃以上の発熱が認められた場合には、本剤を休薬すること。発熱の回復後、24時間以上発熱がない場合には、休薬前と同一の用量で投与を再開すること。38.0℃未満の発熱又は悪寒、戦慄、寝汗、インフルエンザ様症状等の発熱の初期症状の再発が認められた時点で本剤の休薬を検討すること。必要に応じて、7.2項の用量調節の目安を参考に、本剤を減量すること。本剤を休薬しても4週間以内に発熱がGrade1以下又はベースラインに軽快しない場合は、本剤の投与を中止すること。
【8.重要な基本的注意】(一部改訂)
【新様式】
発熱が高頻度に認められ、重度の脱水、低血圧を伴う例も報告されているので、患者の状態を十分に観察し、異常が認められた場合には減量、休薬や解熱剤の投与など適切な処置を行い、感染症等の有無を評価すること。解熱剤で効果が不十分な場合には、経口ステロイド剤の投与を検討すること。
2024年1月24日 DSU No.323 【その他】
【5.効能又は効果に関連する注意】(一部改訂)
【新様式】
〈効能共通〉
十分な経験を有する病理医又は検査施設における検査により、BRAF遺伝子変異が確認された患者に投与すること。検査にあたっては、承認された体外診断用医薬品又は医療機器を用いること。なお、承認された体外診断用医薬品又は医療機器に関する情報については、以下のウェブサイトから入手可能である:
https://www.pmda.go.jp/review-services/drug-reviews/review-information/cd/0001.html
【5.効能又は効果に関連する注意】(追記)
【新様式】
〈固形腫瘍〉
組織球症患者は本剤の投与対象となり得る。
【5.効能又は効果に関連する注意】(追記)
【新様式】
臨床試験に組み入れられた患者のがん種等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、本剤以外の治療の実施についても慎重に検討し、適応患者の選択を行うこと。
【5.効能又は効果に関連する注意】(追記)
【新様式】
本剤の手術の補助療法における有効性及び安全性は確立していない。
【5.効能又は効果に関連する注意】(追記)
【新様式】
〈有毛細胞白血病〉
臨床試験に組み入れられた患者の前治療歴等について、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。
【6.用法及び用量】(一部改訂)
【新様式】
〈非小細胞肺癌、有毛細胞白血病〉
ダブラフェニブとの併用において、通常、成人にはトラメチニブとして2mgを1日1回、空腹時に経口投与する。なお、患者の状態により適宜減量する。
【6.用法及び用量】(追記)
【新様式】
〈固形腫瘍〉
ダブラフェニブとの併用において、通常、トラメチニブとして以下の用量を1日1回、空腹時に経口投与する。なお、患者の状態により適宜減量する。
・成人には、2mg
・小児には、体重に合わせて次の用量
【7.用法及び用量に関連する注意】(一部改訂)
【新様式】
〈効能共通〉
本剤投与により副作用が発現した場合には、下記の基準を参考に、本剤を休薬、減量又は中止すること。ただし、有棘細胞癌(皮膚の扁平上皮癌)又は新たな原発性悪性黒色腫が発現した場合には、外科的切除等の適切な処置を行った上で、休薬、減量することなく治療を継続することができる。
【7.用法及び用量に関連する注意】(一部改訂)
【新様式】
休薬、減量及び中止基準
注1)NCI-CTCAE v4.0によりGradeを判定
【7.用法及び用量に関連する注意】(一部改訂)
【新様式】
用量調節の目安(成人)
注2)適切な処置により副作用が管理できた場合には、減量時と逆の段階を経て増量可
【7.用法及び用量に関連する注意】(一部改訂)
【新様式】
用量調節の目安(小児)
【7.用法及び用量に関連する注意】(追記)
【新様式】
〈固形腫瘍〉
26kg未満の小児患者における有効性及び安全性は確立していない。
【9.7小児等】(一部改訂)
【新様式】
〈悪性黒色腫、非小細胞肺癌、有毛細胞白血病〉
小児等を対象とした臨床試験は実施していない。
【9.7小児等】(追記)
【新様式】
〈固形腫瘍〉
低出生体重児、新生児を対象とした臨床試験は実施していない。また、6歳未満の患者に対する本剤の用法及び用量について、十分な検討は行われていない。
【11.2その他の副作用】(一部改訂)
【新様式】
〈ダブラフェニブとの併用時〉
【15.2非臨床試験に基づく情報】(追記)
【新様式】
幼若ラットの0.0125mg/kg/日/0.08mg/kg/日(生後7~21日の投与量/生後22~45日の投与量)(成人の臨床曝露量(AUC)の約0.3倍)以上の群で成長・発達(体重減少、骨長の短縮、腟開口の遅延)、骨(大腿骨一次海綿骨壊死等)等への影響がみられた。
医師の処方により使用する医薬品。
特定薬剤管理指導加算等の算定対象となる薬剤。


