プレバイミス点滴静注240mg
医療用
医療用医薬品:
医師の処方により使用する医薬品
医師の処方により使用する医薬品
医薬品コード(YJコード):6250406A1029
- 収載区分
- 銘柄別収載
- 先発・後発情報
- 先発品(後発品なし)
- オーソライズド
ジェネリック - -
- 一般名
- レテルモビル注射液
- 英名(商品名)
- Prevymis
- 規格
- 240mg12mL1瓶
- 薬価
- 18,228.00
- メーカー名
- MSD
- 規制区分
- 劇薬
- 長期投与制限
- -
- 標榜薬効
- 抗サイトメガロウイルス薬
- 色
- -
- 識別コード
- -
- [@: メーカーロゴ]
- 添付文書
-
PDF 2025年10月改訂(第6版)
- 告示日
- 2018年5月21日
- 経過措置期限
- -
- 医薬品マスタに反映
- 2018年6月版
- 医薬品マスタ削除予定
- -
- 運転注意
- 情報なし(使用の適否を判断するものではありません)
- ドーピング
- 禁止物質なし(使用の適否を判断するものではありません)
- CP換算
- -
- 長期収載品選定療養
- -
[識別コードの表記 @: メーカーロゴ]
効能効果
次記におけるサイトメガロウイルス感染症の発症抑制:1)同種造血幹細胞移植、2)臓器移植。
(効能又は効果に関連する注意)
〈臓器移植〉腎移植以外の臓器移植患者を対象に本剤の有効性及び安全性を評価する臨床試験は実施していない。
用法用量
通常、成人にはレテルモビルとして480mgを1日1回、約60分かけて点滴静注する。シクロスポリンと併用投与する場合にはレテルモビルとして240mgを1日1回、約60分かけて点滴静注する。
通常、小児にはレテルモビルとして次の用量を1日1回、約60分かけて点滴静注する。
1). 体重30kg以上:480mg(シクロスポリンの併用なし)、240mg(シクロスポリンの併用あり)。
2). 体重15kg以上30kg未満:120mg(シクロスポリンの併用の有無にかかわらない)。
3). 体重7.5kg以上15kg未満:60mg(シクロスポリンの併用の有無にかかわらない)。
4). 体重5kg以上7.5kg未満:40mg(シクロスポリンの併用の有無にかかわらない)。
(用法及び用量に関連する注意)
7.1. 〈効能共通〉経口剤(錠剤及び顆粒剤)と注射剤は医師の判断で切り替えて使用することができる。なお、体重30kg未満の小児では、切り替える際に用量の調節が必要となる場合がある。ただし、臨床試験において注射剤の長期投与の経験はなく、注射剤の添加剤ヒドロキシプロピル-β-シクロデキストリンは腎機能障害のある患者で蓄積し、腎機能の悪化等を引き起こす恐れがあることから、注射剤の投与は最小限の期間とし、経口投与可能な患者には、経口投与を選択すること〔9.2.1参照〕。
7.2. 〈効能共通〉サイトメガロウイルス血症又はサイトメガロウイルス感染症が確認された場合には、本剤の投与を中止し、サイトメガロウイルスに対する治療等、適切な対応を行うこと〔17.1.1-17.1.5参照〕。
7.3. 〈同種造血幹細胞移植〉同種造血幹細胞移植の移植当日から移植後28日目までを目安として投与を開始すること(投与期間は、患者のサイトメガロウイルス感染症の発症リスクを考慮しながら、移植後200日目までを目安とすること)〔17.1.1-17.1.3参照〕。
7.4. 〈臓器移植〉移植後早期より投与を開始し、投与期間は、患者のサイトメガロウイルス感染症の発症リスクを考慮しながら、移植後200日目までを目安とすること(ただし、レテルモビルは主に肝を介して消失するため、移植後に肝機能が安定しない場合、血漿中濃度が上昇するおそれがあることから、投与可否を慎重に判断すること)〔9.3.1、16.6.2、17.1.4、17.1.5参照〕。
改訂情報
2025年11月5日 DSU No.340 【その他】
【14.適用上の注意】(一部改訂)
[配合変化]
本剤は他剤と配合したとき、濁りや不溶性異物が生じることがある。配合適性についてはデータが限られているが、次の薬剤は配合禁忌であり、同一の輸液ラインを通して同時に注入しないこと。
主な配合禁忌薬剤:アミオダロン塩酸塩、アムホテリシンBリポソーム、アズトレオナム、セフェピム塩酸塩、シプロフロキサシン、シクロスポリン、ジルチアゼム塩酸塩、フィルグラスチム(遺伝子組換え)、ゲンタマイシン硫酸塩、レボフロキサシン、リネゾリド、ロラゼパム、ミダゾラム、オンダンセトロン塩酸塩、パロノセトロン塩酸塩
2025年4月22日 DSU No.335 【その他】
【6.用法及び用量】(一部改訂)
通常、成人にはレテルモビルとして480mgを1日1回、約60分かけて点滴静注する。シクロスポリンと併用投与する場合にはレテルモビルとして240mgを1日1回、約60分かけて点滴静注する。
通常、小児にはレテルモビルとして以下の用量を1日1回、約60分かけて点滴静注する。
【7.用法及び用量に関連する注意】(一部改訂)
〈効能共通〉
経口剤(錠剤及び顆粒剤)と注射剤は医師の判断で切り替えて使用することができる。なお、体重30㎏未満の小児では、切り替える際に用量の調節が必要となる場合がある。ただし、臨床試験において注射剤の長期投与の経験はなく、注射剤の添加剤ヒドロキシプロピル-β-シクロデキストリンは腎機能障害のある患者で蓄積し、腎機能の悪化等を引き起こすおそれがあることから、注射剤の投与は最小限の期間とし、経口投与可能な患者には、経口投与を選択すること。
【9.7小児等】(一部改訂)
〈臓器移植〉
小児等を対象とした臨床試験は実施していない。
【14.適用上の注意】(一部改訂)
[薬剤調製時の注意]
バイアルから溶液を採取して日局生理食塩液又は日局5%ブドウ糖注射液が入った点滴バッグに添加し、振盪せず静かに混和すること。
60~480mgを投与する場合、バイアルからの採取液量、点滴バッグの液量は以下を参照し、点滴バッグの総液量を投与すること。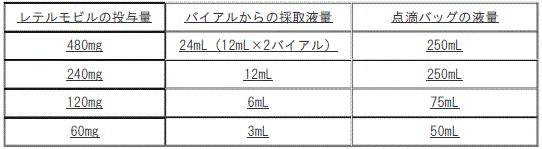
40mgを投与する場合、1バイアル(レテルモビル濃度20mg/mL)から5mLを採取し、45mLの日局生理食塩液又は日局5%ブドウ糖注射液が入った点滴バッグに添加し、振盪せず静かに混和すること。当該希釈液を20mL投与すること。
【15.2非臨床試験に基づく情報】(追記)
添加剤であるヒドロキシプロピル-β-シクロデキストリンが投与された複数の動物種(マウス、ラット及びネコ)において、聴覚パラメータの変化及び内耳の外有毛細胞の減少が報告されている。なお、ラットでは、最大推奨臨床用量の約3倍(体表面積換算値)である2,000mg/kgの投与においてこれらの所見が認められた。
医師の処方により使用する医薬品。



 で医薬品を比較する
で医薬品を比較する
