「薬の検索」は、下記の内容に同意いただいた上でご利用ください。
禁止事項
- 掲載された情報の一括大量ダウンロード
- 許可無くコンテンツの一部または全部を流用したコンテンツの作成
- PDFファイルや画像ファイルへのリンク
注意事項
- 本サービスでは最新情報を提供するよう努力致しますが、医薬品の情報は随時更新されるため、すべての情報が最新とは限らず、その正確性および完全性等に関してはいかなる保証もするものではありません。最新情報については、各製薬メーカー、厚生労働省、医薬品医療機器総合機構が提供する情報を適宜ご参照ください。
- 本サービスの情報をもとにご自身の判断で薬の使用や中止をするようなことはせず、必ず医師や薬剤師にご相談ください。
- 添付文書情報が未入手の薬品もございますので、予めご了承ください。
- 運転注意対象薬の検索結果は、薬の使用の適否を判断するものではありません。必ず担当の医師や薬剤師にご相談ください。
- ドーピング対象薬の検索結果は、薬の使用の適否を判断するものではありません。薬を使用する際は、必ず医師や薬剤師、各競技団体等にご相談ください。
- ドーピング対象薬検索は医薬品の有効成分を対象としており、添加物は対象外です。
- OTC医薬品は医薬品の有効成分を対象としており、添加物は対象外です。
- OTC医薬品は医師の処方がなくても購入できますが、症状の悪化、副作用・事故等を防ぐために、必ず添付文書をよく読み、指示に従って使用してください。
ご利用条件
このWebサイト(以下、当サイト)は、データインデックス株式会社(以下、当社)により開設、運営されています。
ご利用に先立ち、下記のご利用条件をご熟読いただきたく、お願い申し上げます。なお、一旦ご利用を開始されました後は、下記のご利用条件および関連するすべての法律の遵守いただくことをご承諾いただいたものとみなします。
著作権について
当サイトに含まれるすべての内容は、当社および当該内容提供者の財産であり、各国の著作権法、各種条約およびその他の法律によって保護されております。当サイトの利用は、非営利目的の個人的利用の範囲内に限るものとし、この範囲を超えてのダウンロード、複製等一切の利用を禁じます。また、いかなる場合においても、内容に変更を加えたり、更なる複製を行うことを禁じます。
商標等について
当サイトに表示されている商標、ロゴマーク、商号等は法的に保護されています。これらの無断使用などの侵害行為を禁じます。
免責事項
当サイトに掲載する情報に関して細心の注意を払っておりますが、その内容の正確性・有用性・完全性、およびエラー・ウィルス感染等の危険がないことの安全性等のいずれについても保証するものではなく、いかなる責任を負うものでもありません。また、当サイトないしは当サイトに掲載された情報を利用されたこと、または利用できなかったことにより生じるいかなる損害についても何ら責任を負いません。また、予告なしに当サイトに掲載する情報の内容を変更したり、サイトを閉鎖させていただくことがありますので、予めご了承ください。
医療情報について
当サイトに掲載されている医療情報は、一般的な情報提供を目的としており、決して医師その他医療従事者によるアドバイスの代替となるものではありません。
また、当サイトに掲載されている医薬品に関する情報は、日本における医薬品添付文書の情報をもとに作成しており、日本以外の国での利用においては、これらの情報が適切でない場合がありますので、それぞれの国における承認の有無や承認内容をご確認ください。
なお、当サイトに掲載されている医薬品に関する情報は、その製品の効能・効果を宣伝または広告するものではありません。
ブラウザの推奨環境について
当サイトのコンテンツを快適にご利用いただくために、下記のWebブラウザでご覧いただくことを推奨致します。環境が満たされていない場合、各種コンテンツを正しくご利用いただけない場合がございます。
PC:Microsoft Edge、Mozilla Firefox、Safari、Google Chrome 各最新(推奨画面サイズ:横幅 1024px以上)
スマートフォン:Safari、Google Chrome 各最新
iPhone:OS14以上、Android:OS9以上
アクセス情報の取得について
当サイトでは、サービスの利便性向上を目的として、個人の特定が可能な情報を除いた範囲でCookieやアクセスログを利用して、利用者のアクセス情報を収集しておりますので、予めご了承ください。
電子メールによる情報について
電子メール等により利用者から一方的に提供される情報・資料に対しては、何ら返信の義務を負うものではなく、利用者の個人情報(取扱いについては別途個人情報保護方針で規定しておりますのでご参照ください)を除き、機密の取扱いを致しかねます。また、当社は、個人情報を除いた当該情報・資料をいかなる目的にも無償で自由に利用できるものとします。
リンクについて
当サイトへのリンクをご希望の場合は、事前に当社へご連絡いただき承諾を得てください。また、当サイトにリンクしている第三者のWebサイト、または当サイトがリンクを設けている第三者のWebサイトについては、一切の責任を負いません。
ご連絡は、お問い合わせ等をご利用ください。
雑誌などへの掲載について
雑誌書籍、広告などの出版物等の各種メディアへの掲載を希望される場合は、事前に当社へご連絡いただき承諾を得てください。
ご連絡は、お問い合わせ等をご利用ください。
英語サイトについて
英語サイトの内容は、原則として日本語サイトに掲載された原文の翻訳とし、日本語サイトの原文と英語サイトの翻訳に齟齬がある場合は、日本語の原文の内容を優先します。
その他
この利用条件は、日本法を準拠法とし、それに基づいて解釈されるものとします。この利用条件に関わるすべての紛争については、東京地方裁判所を第一審の専属的管轄裁判所とするものとします。
イグザレルト錠2.5mg
医療用
医療用医薬品:
医師の処方により使用する医薬品
医師の処方により使用する医薬品
- 収載区分
- 銘柄別収載
- 先発・後発情報
- 先発品(後発品なし)
- オーソライズド
ジェネリック - -
- 一般名
- リバーロキサバン錠
- 英名(商品名)
- Xarelto
- 規格
- 2.5mg1錠
- 薬価
- 114.40
- メーカー名
- バイエル薬品
- 規制区分
- -
- 長期投与制限
- -
- 標榜薬効
- 血液凝固第10a因子(F10a)阻害薬
- 色
- 淡黄
- 識別コード
- (本体)@ 2.5 (本体)@ (本体)BAYER (被包)@2.5 2.5 (被包)@ (被包)BAYER
- [@: メーカーロゴ]
- 添付文書
-
PDF 2024年11月改訂(第7版)
- 告示日
- 2022年8月17日
- 経過措置期限
- -
- 医薬品マスタに反映
- 2022年9月版
- 医薬品マスタ削除予定
- -
- 運転注意
- 情報なし(使用の適否を判断するものではありません)
- ドーピング
- 禁止物質なし(使用の適否を判断するものではありません)
- CP換算
- -
- 長期収載品選定療養
- -
[識別コードの表記 @: メーカーロゴ]
効能効果
1). 成人:下肢血行再建術施行後の末梢動脈疾患患者における血栓・塞栓形成の抑制。
2). 小児:Fontan手術施行後における血栓・塞栓形成の抑制。
用法用量
〈下肢血行再建術施行後の末梢動脈疾患患者における血栓・塞栓形成の抑制〉
通常、成人にはリバーロキサバンとして2.5mgを1日2回経口投与する。
〈Fontan手術施行後における血栓・塞栓形成の抑制〉
通常、体重20kg以上30kg未満の小児にはリバーロキサバンとして2.5mgを1日2回、体重30kg以上50kg未満の小児には7.5mgを1日1回経口投与する。
(用法及び用量に関連する注意)
7.1. 〈下肢血行再建術施行後の末梢動脈疾患患者における血栓・塞栓形成の抑制〉アスピリン(81~100mg/日)と併用すること(なお、患者の状態に応じて本剤又はアスピリンの中断等を考慮すること)〔10.2参照〕。
7.2. 〈下肢血行再建術施行後の末梢動脈疾患患者における血栓・塞栓形成の抑制〉下肢血行再建術施行後の初期治療において抗血小板剤2剤併用療法が必要な場合は、アスピリンとクロピドグレルを使用すること(クロピドグレルの使用期間は必要最低限にとどめること)〔8.4、10.2参照〕。
7.3. 〈下肢血行再建術施行後の末梢動脈疾患患者における血栓・塞栓形成の抑制〉本剤の投与は、下肢血行再建術が成功し、止血が確認できた後、早期に開始すること〔17.1.1参照〕。
7.4. 〈Fontan手術施行後における血栓・塞栓形成の抑制〉体重20kg未満の小児等に投与する場合は、リバーロキサバンドライシロップを使用すること(体重20kg以上50kg未満で本剤(錠剤)の服用が困難な小児等には、リバーロキサバンドライシロップを選択すること)。
外形画像


改訂情報
2024年11月27日 DSU No.331 【その他】
【2.禁忌】(一部改訂)
リトナビルを含有する製剤、アタザナビル、ダルナビル、ホスアンプレナビルを投与中の患者
【2.禁忌】(一部改訂)
イトラコナゾール、ポサコナゾール、ボリコナゾール、ミコナゾール、ケトコナゾールの経口又は注射剤を投与中の患者
【10.1併用禁忌】(一部改訂)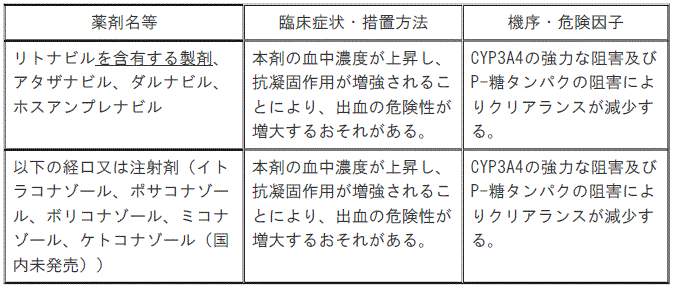
2024年5月22日 DSU No.326 【重要】
【2.禁忌】(一部改訂)
【新様式】
〈効能共通〉
アゾール系抗真菌剤(イトラコナゾール、ボリコナゾール、ミコナゾール、ポサコナゾール、ケトコナゾール)の経口又は注射剤を投与中の患者
【10.1併用禁忌】(一部改訂)
【新様式】
2024年5月22日 DSU No.326 【その他】
【10.1併用禁忌】(削除)
【新様式】
エルビテグラビル・コビシスタット・エムトリシタビン・テノホビルジソプロキシルフマル酸塩
2024年5月8日 使用上の注意改訂情報 令和6年5月8日指示分
【2. 禁忌(次の患者には投与しないこと)】(一部改訂)
【新記載要領】
〈効能共通〉
アゾール系抗真菌剤(イトラコナゾール、ボリコナゾール、ミコナゾール、ポサコナゾール、ケトコナゾール)の経口又は注射剤を投与中の患者
【10. 相互作用-10.1 併用禁忌(併用しないこと)】(一部改訂)
【新記載要領】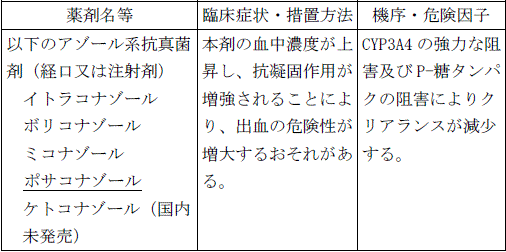
類似した薬効の薬
よく一緒に見られている薬
医師の処方により使用する医薬品。
特定薬剤管理指導加算等の算定対象となる薬剤。



 で医薬品を比較する
で医薬品を比較する
