イグザレルトドライシロップ小児用51.7mg
医療用
医療用医薬品:
医師の処方により使用する医薬品
医師の処方により使用する医薬品
- 収載区分
- 銘柄別収載
- 先発・後発情報
- 先発品(後発品なし)
- オーソライズド
ジェネリック - -
- 一般名
- リバーロキサバンシロップ用
- 英名(商品名)
- Xarelto
- 規格
- 51.7mg1瓶
- 薬価
- 5,307.20
- メーカー名
- バイエル薬品
- 規制区分
- -
- 長期投与制限
- -
- 標榜薬効
- 血液凝固第10a因子(F10a)阻害薬
- 色
- 白
- 識別コード
- -
- [@: メーカーロゴ]
- 添付文書
-
PDF 2024年11月改訂(第6版)
- 告示日
- 2021年4月20日
- 経過措置期限
- -
- 医薬品マスタに反映
- 2021年5月版
- 医薬品マスタ削除予定
- -
- 運転注意
- 情報なし(使用の適否を判断するものではありません)
- ドーピング
- 禁止物質なし(使用の適否を判断するものではありません)
- CP換算
- -
- 長期収載品選定療養
- -
[識別コードの表記 @: メーカーロゴ]
効能効果
1). 静脈血栓塞栓症の治療及び再発抑制。
2). Fontan手術施行後における血栓・塞栓形成の抑制。
(効能又は効果に関連する注意)
5.1. 〈静脈血栓塞栓症の治療及び再発抑制〉静脈血栓塞栓症の治療及び再発抑制の場合、本剤は急性期への適切な初期治療(ヘパリン投与等)が5日以上なされた後に投与すること。
5.2. 〈静脈血栓塞栓症の治療及び再発抑制〉下大静脈フィルターが留置された患者に対する本剤の安全性及び有効性は検討されていない。
用法用量
〈静脈血栓塞栓症の治療及び再発抑制〉
通常、体重2.6kg以上12kg未満の小児には次記の用量を1回量とし、1日3回経口投与する。体重12kg以上30kg未満の小児にはリバーロキサバンとして5mgを1日2回、体重30kg以上の小児には15mgを1日1回経口投与する。いずれも空腹時を避けて投与し、1日1回、2回及び3回投与においては、それぞれ約24時間、約12時間及び約8時間おきに投与する。
1). 体重2.6kg以上3kg未満:1回量0.8mg(リバーロキサバン1mgは懸濁液1mLに相当)1日3回、1日用量2.4mg。
2). 体重3kg以上4kg未満:1回量0.9mg(リバーロキサバン1mgは懸濁液1mLに相当)1日3回、1日用量2.7mg。
3). 体重4kg以上5kg未満:1回量1.4mg(リバーロキサバン1mgは懸濁液1mLに相当)1日3回、1日用量4.2mg。
4). 体重5kg以上7kg未満:1回量1.6mg(リバーロキサバン1mgは懸濁液1mLに相当)1日3回、1日用量4.8mg。
5). 体重7kg以上8kg未満:1回量1.8mg(リバーロキサバン1mgは懸濁液1mLに相当)1日3回、1日用量5.4mg。
6). 体重8kg以上9kg未満:1回量2.4mg(リバーロキサバン1mgは懸濁液1mLに相当)1日3回、1日用量7.2mg。
7). 体重9kg以上10kg未満:1回量2.8mg(リバーロキサバン1mgは懸濁液1mLに相当)1日3回、1日用量8.4mg。
8). 体重10kg以上12kg未満:1回量3.0mg(リバーロキサバン1mgは懸濁液1mLに相当)1日3回、1日用量9.0mg。
9). 体重12kg以上30kg未満:1回量5mg(リバーロキサバン1mgは懸濁液1mLに相当)1日2回、1日用量10mg。
10). 体重30kg以上:1回量15mg(リバーロキサバン1mgは懸濁液1mLに相当)1日1回、1日用量15mg。
〈Fontan手術施行後における血栓・塞栓形成の抑制〉
通常、2歳以上の小児には、体重に応じて次記の用量を1回量とし、1日2回又は1日1回経口投与する。1日1回及び2回投与においては、それぞれ約24時間及び約12時間おきに投与する。
1). 体重7kg以上8kg未満:1回量1.1mg(リバーロキサバン1mgは懸濁液1mLに相当)1日2回、1日用量2.2mg。
2). 体重8kg以上10kg未満:1回量1.6mg(リバーロキサバン1mgは懸濁液1mLに相当)1日2回、1日用量3.2mg。
3). 体重10kg以上12kg未満:1回量1.7mg(リバーロキサバン1mgは懸濁液1mLに相当)1日2回、1日用量3.4mg。
4). 体重12kg以上20kg未満:1回量2.0mg(リバーロキサバン1mgは懸濁液1mLに相当)1日2回、1日用量4.0mg。
5). 体重20kg以上30kg未満:1回量2.5mg(リバーロキサバン1mgは懸濁液1mLに相当)1日2回、1日用量5.0mg。
6). 体重30kg以上50kg未満:1回量7.5mg(リバーロキサバン1mgは懸濁液1mLに相当)1日1回、1日用量7.5mg。
7). 体重50kg以上:1回量10mg(リバーロキサバン1mgは懸濁液1mLに相当)1日1回、1日用量10mg。
改訂情報
2024年11月27日 DSU No.331 【その他】
【2.禁忌】(一部改訂)
リトナビルを含有する製剤、アタザナビル、ダルナビル、ホスアンプレナビルを投与中の患者
【2.禁忌】(一部改訂)
イトラコナゾール、ポサコナゾール、ボリコナゾール、ミコナゾール、ケトコナゾールの経口又は注射剤を投与中の患者
【10.1併用禁忌】(一部改訂)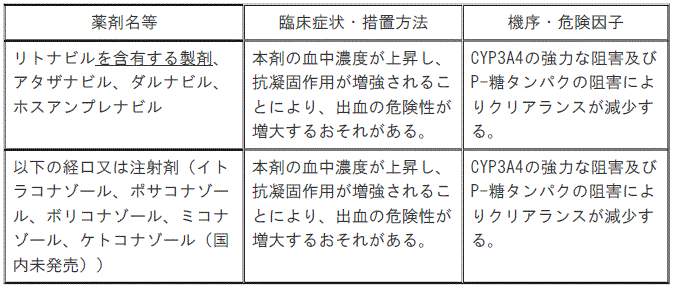
2024年5月22日 DSU No.326 【重要】
【2.禁忌】(一部改訂)
【新様式】
〈効能共通〉
アゾール系抗真菌剤(イトラコナゾール、ボリコナゾール、ミコナゾール、ポサコナゾール、ケトコナゾール)の経口又は注射剤を投与中の患者
【10.1併用禁忌】(一部改訂)
【新様式】
2024年5月22日 DSU No.326 【その他】
【10.1併用禁忌】(削除)
【新様式】
エルビテグラビル・コビシスタット・エムトリシタビン・テノホビルジソプロキシルフマル酸塩
2024年5月8日 使用上の注意改訂情報 令和6年5月8日指示分
【2. 禁忌(次の患者には投与しないこと)】(一部改訂)
【新記載要領】
〈効能共通〉
アゾール系抗真菌剤(イトラコナゾール、ボリコナゾール、ミコナゾール、ポサコナゾール、ケトコナゾール)の経口又は注射剤を投与中の患者
【10. 相互作用-10.1 併用禁忌(併用しないこと)】(一部改訂)
【新記載要領】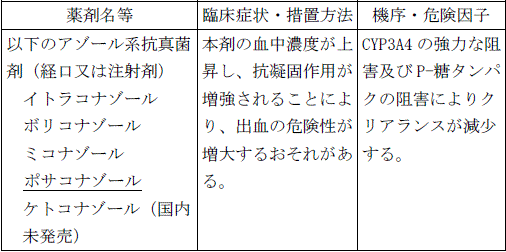
医師の処方により使用する医薬品。
特定薬剤管理指導加算等の算定対象となる薬剤。



 で医薬品を比較する
で医薬品を比較する
