ケレンディア錠20mg
医療用
医療用医薬品:
医師の処方により使用する医薬品
医師の処方により使用する医薬品
医薬品コード(YJコード):2190044F2027
- 収載区分
- 銘柄別収載
- 先発・後発情報
- 先発品(後発品なし)
- オーソライズド
ジェネリック - -
- 一般名
- フィネレノン錠
- 英名(商品名)
- Kerendia
- 規格
- 20mg1錠
- 薬価
- 205.80
- メーカー名
- バイエル薬品
- 規制区分
- -
- 長期投与制限
- -
- 標榜薬効
- 慢性腎臓病治療薬〔抗アルドステロン薬〕
- 色
- 淡黄
- 識別コード
- (本体)20 (本体)FI (被包)20mg 20FI @ (被包)20mg 20FI BAYER
- [@: メーカーロゴ]
- 添付文書
-
PDF 2024年6月改訂(第6版)
- 告示日
- 2022年5月24日
- 経過措置期限
- -
- 医薬品マスタに反映
- 2022年6月版
- DIRに反映
- 2022年6月版
- DIR削除予定
- -
- 運転注意
-
注意情報あり(使用の適否を判断するものではありません)注意
- ドーピング
-
禁止物質あり(使用の適否を判断するものではありません)
競技会区分:常に禁止(競技会検査及び競技会外検査)
セクション:S5. 利尿剤及び隠蔽剤
- CP換算
- -
- 長期収載品選定療養
- -
[識別コードの表記 @: メーカーロゴ]
効能効果
2型糖尿病を合併する慢性腎臓病<末期腎不全又は透析施行中の患者を除く>。
(効能又は効果に関連する注意)
5.1. アンジオテンシン変換酵素阻害薬又はアンジオテンシン2受容体拮抗薬による治療が適さない場合を除き、これらの薬剤が投与されている患者に投与すること。
5.2. 本剤投与によりeGFRが低下することがあることから、eGFRが25mL/min/1.73㎡未満の患者には、リスクとベネフィットを考慮した上で、本剤投与の適否を慎重に判断すること〔8.2、9.2.1参照〕。
5.3. 日本人部分集団では、国際共同第3相試験(試験16244)の主要評価項目の腎複合エンドポイントにおいて、本剤のプラセボに対するハザード比は0.911であった一方で、国際共同第3相試験(試験16244)の主要評価項目の構成要素の腎不全、及び国際共同第3相試験(試験17530)の副次評価項目の腎複合エンドポイントにおいては、本剤のプラセボに対するハザード比が1を上回った。試験の対象となった全体集団と比べて日本人では本剤の腎不全への進展抑制効果が弱い可能性がある〔17.1.1、17.1.2参照〕。
5.4. 「17.臨床成績」の項の内容を熟知し、臨床試験に組み入れられた患者の背景(原疾患、併用薬、腎機能、アルブミン尿等)を十分に理解した上で、適応患者を選択すること〔17.1.1、17.1.2参照〕。
用法用量
通常、成人にはフィネレノンとして次の用量を1日1回経口投与する。
eGFRが60mL/min/1.73㎡以上:20mg。
eGFRが60mL/min/1.73㎡未満:10mgから投与を開始し、血清カリウム値、eGFRに応じて、投与開始から4週間後を目安に20mgへ増量する。
(用法及び用量に関連する注意)
7.1. 投与開始又は再開、増量から4週間後、その後も定期的に血清カリウム値及びeGFRを測定し、次に従って用量を調節すること〔8.1、8.2参照〕。
1). 血清カリウム値4.8mEq/L以下の場合:
①. 血清カリウム値4.8mEq/L以下の場合:20mg1日1回の場合;維持。
②. 血清カリウム値4.8mEq/L以下の場合:10mg1日1回の場合;20mg1日1回に増量(ただし、eGFRが前回の測定から30%を超えて低下していない場合に限る)。
2). 血清カリウム値4.8mEq/L超5.5mEq/L以下の場合:維持。
3). 血清カリウム値5.5mEq/L超の場合:中止(投与中止後、血清カリウム値が5.0mEq/L以下に下がった場合には、10mgを1日1回から投与を再開することができる)。
7.2. 10mg錠と20mg錠の生物学的同等性は示されていないため、20mgを投与する際には10mg錠を使用しないこと〔16.1.3参照〕。
外形画像
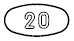

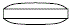
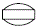
改訂情報
2024年6月25日 DSU No.327 【重要】
【2.禁忌】(一部改訂)
イトラコナゾール、ポサコナゾール、ボリコナゾール、リトナビルを含有する製剤、アタザナビル、ダルナビル、ホスアンプレナビル、コビシスタットを含有する製剤、クラリスロマイシン、エンシトレルビルを投与中の患者
【10.1併用禁忌】(一部改訂)
2024年6月25日 DSU No.327 【その他】
【10.1併用禁忌】(削除)
エルビテグラビル・コビシスタット・エムトリシタビン・テノホビルジソプロキシルフマル酸塩
2024年6月11日 使用上の注意改訂情報 令和6年6月11日指示分
【2. 禁忌(次の患者には投与しないこと)】(一部改訂)
【新記載要領】
イトラコナゾール、ポサコナゾール、ボリコナゾール、リトナビルを含有する製剤、アタザナビル、ダルナビル、ホスアンプレナビル、コビシスタットを含有する製剤、クラリスロマイシン、エンシトレルビルを投与中の患者
【10. 相互作用-10.1 併用禁忌(併用しないこと)】(一部改訂)
【新記載要領】

よく一緒に見られている薬
医師の処方により使用する医薬品。


