ダントリウムカプセル25mg
医療用
医療用医薬品:
医師の処方により使用する医薬品
医師の処方により使用する医薬品
医薬品コード(YJコード):1229002M1036
- 収載区分
- 銘柄別収載
- 先発・後発情報
- 先発品(後発品なし)
- オーソライズド
ジェネリック - -
- 一般名
- ダントロレンナトリウム水和物カプセル
- 英名(商品名)
- Dantrium
- 規格
- 25mg1カプセル
- 薬価
- 18.90
- メーカー名
- オーファンパシフィック
- 規制区分
- -
- 長期投与制限
- -
- 標榜薬効
- 末梢性筋弛緩薬
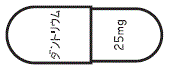
- 色
- 橙:薄褐
- 識別コード
- (本体)ダントリウム 25mg (被包)25mg
- [@: メーカーロゴ]
- 添付文書
-
PDF 2023年11月改訂(第1版)
- 告示日
- 2006年6月9日
- 経過措置期限
- -
- 医薬品マスタに反映
- -
- DIRに反映
- 2006年10月版
- DIR削除予定
- -
- 運転注意
-
禁止情報あり(使用の適否を判断するものではありません)禁止
- ドーピング
- 禁止物質なし(使用の適否を判断するものではありません)
- CP換算
- -
- 長期収載品選定療養
- -
[識別コードの表記 @: メーカーロゴ]
効能効果
1). 次記疾患に伴う痙性麻痺:脳血管障害後遺症、脳性麻痺、外傷後遺症(頭部外傷後遺症、脊髄損傷後遺症)、頸部脊椎症、後縦靭帯骨化症、脊髄小脳変性症、痙性脊髄麻痺、脊髄炎、脊髄症、筋萎縮性側索硬化症、多発性硬化症、スモン(SMON)、潜水病。
2). 全身こむら返り病。
3). 悪性症候群。
用法用量
〈痙性麻痺及び全身こむら返り病〉
通常、成人にはダントロレンナトリウム水和物として1日1回25mgより投与を始め、1週毎に25mgずつ増量し(1日2~3回に分割投与)維持量を決定する。ただし、1日最高投与量は150mgとし3回に分割投与する。
〈悪性症候群〉
ダントロレンナトリウム水和物注射剤の静脈内投与後、継続投与が必要で経口投与が可能な場合、通常、成人にはダントロレンナトリウム水和物として1回25mg又は50mgを1日3回経口投与する。なお、年齢、症状により適宜増減する。
外形画像
改訂情報
2023年12月6日 DSU No.322 【その他】
【9.4生殖能を有する者】(新設)
【新様式】
妊娠する可能性のある女性には、本剤投与中及び最終投与後6カ月間において避妊する必要性及び適切な避妊法について説明すること。
【9.4生殖能を有する者】(新設)
【新様式】
男性には、本剤投与中及び最終投与後3カ月間においてバリア法(コンドーム)を用いて避妊する必要性について説明すること。
【9.5妊婦】(一部改訂)
【新様式】
妊婦又は妊娠している可能性のある女性には投与しないことが望ましい。また妊娠13日目及び19日目の雌ラットに14C-ダントロレンナトリウム水和物1mg/kgを経口投与した際、胎児へ移行することが報告されている。
【9.6授乳婦】(一部改訂)
【新様式】
授乳しないことが望ましい。分娩後14日目の雌ラットに14C-ダントロレンナトリウム水和物1mg/kgを経口投与した際、乳汁中に移行することが報告されている。
【15.2非臨床試験に基づく情報】(削除)
【新様式】
1日用量200mgを超えて投与したとき、肝障害発生頻度が高くなるとの報告がある。
【15.2非臨床試験に基づく情報】(削除)
【新様式】
一方、マウスを用いた24カ月間長期がん原性試験では、本剤のがん原性を示唆する所見は認められなかった。
【15.2非臨床試験に基づく情報】(一部改訂)
【新様式】
細菌を用いた復帰突然変異試験(Ames試験)において、変異原性が報告されている。また、ほ乳類培養細胞を用いた染色体異常試験において、染色体異常誘発性が報告されている。
類似した薬効の薬
よく一緒に見られている薬
医師の処方により使用する医薬品。


