ドウベイト配合錠
医療用
医療用医薬品:
医師の処方により使用する医薬品
医師の処方により使用する医薬品
- 収載区分
- 銘柄別収載
- 先発・後発情報
- 先発品(後発品なし)
- オーソライズド
ジェネリック - -
- 一般名
- ドルテグラビルナトリウム・ラミブジン錠
- 英名(商品名)
- Dovato
- 規格
- 1錠
- 薬価
- 4,792.00
- メーカー名
- ヴィーブヘルスケア/GSK
- 規制区分
- 劇薬
- 長期投与制限
- -
- 標榜薬効
- 抗HIV薬〔HIVインテグラーゼ阻害薬〕・抗HIV薬〔核酸(ヌクレオシド)系HIV逆転写酵素阻害薬(NRTI)〕
- 色
- 白
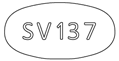
- 識別コード
- (本体)SV137
- [@: メーカーロゴ]
- 添付文書
-
PDF 2024年8月改訂(第8版)
- 告示日
- 2020年1月21日
- 経過措置期限
- -
- 医薬品マスタに反映
- 2020年2月版
- DIRに反映
- 2020年2月版
- DIR削除予定
- -
- 運転注意
- 情報なし(使用の適否を判断するものではありません)
- ドーピング
- 禁止物質なし(使用の適否を判断するものではありません)
- CP換算
- -
- 長期収載品選定療養
- -
[識別コードの表記 @: メーカーロゴ]
効能効果
HIV感染症。
(効能又は効果に関連する注意)
5.1. 次のいずれかのヒト免疫不全ウイルス(HIV)感染症患者に使用すること。
・ 抗HIV薬による治療経験のない患者に使用すること(なお、臨床試験は、主要な耐性変異を有しない患者を対象に実施された)〔17.1.1、17.1.2参照〕。
・ ウイルス学的失敗の経験がなく、切り替え前6ヵ月間以上においてウイルス学的抑制(HIV-1 RNA量が50copies/mL未満)が得られており、本剤の有効成分に対する耐性関連変異を持たず、本剤への切り替えが適切と判断される抗HIV薬既治療患者に使用すること〔17.1.3参照〕。
5.2. 本剤による治療にあたっては、可能な場合には薬剤耐性検査(遺伝子型解析あるいは表現型解析)を参考にすること。
5.3. 本剤はドルテグラビル及びラミブジンの固定用量を含有する配合剤であるので、ラミブジンの用量調節が必要な腎機能障害<クレアチニンクリアランスが30mL/min未満>を有する患者には、個別のドルテグラビル製剤(テビケイ錠)又はラミブジン製剤(エピビル錠)を用いること〔9.2.1、9.2.2、16.6.1参照〕。
用法用量
通常、成人及び12歳以上かつ体重40kg以上の小児には、1回1錠(ドルテグラビルとして50mg及びラミブジンとして300mg)を食事の有無に関わらず1日1回経口投与する。
(用法及び用量に関連する注意)
7.1. 本剤は、HIV感染症に対して1剤で治療を行うものであるため、他の抗HIV薬<ドルテグラビルを追加投与する必要がある場合を除く>と併用しないこと(ただし、ドルテグラビルを追加投与する必要がある場合を除く)〔7.2、10.2参照〕。
7.2. 本剤とカルバマゼピン、リファンピシン、フェニトイン、ホスフェニトイン、フェノバルビタール、セイヨウオトギリソウ<セント・ジョーンズ・ワート>含有食品を併用する場合は、ドルテグラビルとして50mgを本剤投与の約12時間後に投与する〔7.1、10.2、16.7.1参照〕。
7.3. 本剤はラミブジンの固定用量を含有する配合剤であるので、本剤に加えてラミブジン製剤を併用投与しないこと。
外形画像

改訂情報
2024年9月10日 DSU No.329 【その他】
【9.5妊婦】(一部改訂)
海外の観察研究において、無脳症や二分脊椎などの神経管閉鎖障害が、受胎前からドルテグラビル含有製剤を服用していた妊婦から生まれた児9460例中10例(0.11%、95%信頼区間0.06-0.19)に報告されており、ドルテグラビルを含まない抗HIV薬を服用していた妊婦から生まれた児23664例中25例(0.11%、95%信頼区間0.07-0.16)、HIV陰性の妊婦から生まれた児170723例中108例(0.07%、95%信頼区間0.05-0.08)に報告されている。
医師の処方により使用する医薬品。
特定薬剤管理指導加算等の算定対象となる薬剤。


