ボリコナゾール錠200mg「タカタ」
医療用
医療用医薬品:
医師の処方により使用する医薬品
医師の処方により使用する医薬品
医薬品コード(YJコード):6179001F2062
- 収載区分
- 銘柄別収載
- 先発・後発情報
- 後発品(加算対象)
- オーソライズド
ジェネリック - -
- 一般名
- ボリコナゾール錠
- 英名(商品名)
- Voriconazole TAKATA
- 規格
- 200mg1錠
- 薬価
- 513.80
- メーカー名
- 高田製薬
- 規制区分
- 劇薬
- 長期投与制限
- -
- 標榜薬効
- 抗真菌薬〔トリアゾール系抗菌薬〕
- 色
- 白
- 識別コード
- (本体)ボリコナゾール 200タカタ (本体)ボリコナゾール 200タカタ (被包)200 200mg
- [@: メーカーロゴ]
- 添付文書
-
PDF 2025年10月改訂(第6版)
- 告示日
- 2016年6月16日
- 経過措置期限
- -
- 医薬品マスタに反映
- 2016年7月版
- 医薬品マスタ削除予定
- -
- 運転注意
-
禁止情報あり(使用の適否を判断するものではありません)禁止
- ドーピング
- 禁止物質なし(使用の適否を判断するものではありません)
- CP換算
- -
- 長期収載品選定療養
- -
[識別コードの表記 @: メーカーロゴ]
効能効果
1). 次記の重症又は難治性真菌感染症:
・ 侵襲性アスペルギルス症、肺アスペルギローマ、慢性壊死性肺アスペルギルス症。
・ カンジダ血症、食道カンジダ症、カンジダ腹膜炎、気管支カンジダ症・肺カンジダ症。
・ クリプトコックス髄膜炎、肺クリプトコックス症。
・ フサリウム症。
・ スケドスポリウム症。
2). 造血幹細胞移植患者における深在性真菌症の予防。
(効能又は効果に関連する注意)
5.1. 〈カンジダ感染の治療〉他の抗真菌剤が無効あるいは忍容性に問題があると考えられる場合に本剤の使用を考慮すること。
5.2. 〈造血幹細胞移植患者における深在性真菌症の予防〉真菌感染に高リスクの患者(好中球数が500/mm3未満に減少することが予測される患者など)を対象とすること。
用法用量
1). 成人(体重40kg以上):通常、ボリコナゾールとして初日は1回300mgを1日2回、2日目以降は1回150mg又は1回200mgを1日2回食間に経口投与する。なお、患者の状態に応じて、又は効果不十分の場合には、増量できるが、初日投与量の上限は1回400mg1日2回、2日目以降投与量の上限は1回300mg1日2回までとする。
2). 成人(体重40kg未満):通常、ボリコナゾールとして初日は1回150mgを1日2回、2日目以降は1回100mgを1日2回食間に経口投与する。なお、患者の状態に応じて、又は効果不十分の場合には2日目以降の投与量を1回150mg1日2回まで増量できる。
3). 小児(2歳以上12歳未満及び12歳以上で体重50kg未満):ボリコナゾール注射剤による投与を行った後、通常、ボリコナゾールとして1回9mg/kgを1日2回食間に経口投与する。なお、患者の状態に応じて、又は効果不十分の場合には1mg/kgずつ増量し、忍容性が不十分の場合には1mg/kgずつ減量する(最大投与量として350mgを用いた場合は50mgずつ減量する)。
ただし、1回350mg1日2回を上限とする。
4). 小児(12歳以上で体重50kg以上):ボリコナゾール注射剤による投与を行った後、通常、ボリコナゾールとして1回200mgを1日2回食間に経口投与する。なお、患者の状態に応じて、又は効果不十分の場合には1回300mg1日2回まで増量できる。
(用法及び用量に関連する注意)
7.1. 〈効能共通〉注射剤からボリコナゾールの投与を開始した成人患者において、経口投与可能であると医師が判断した場合は、錠剤、顆粒又はドライシロップに切り替えることができる。
7.2. 〈効能共通〉小児においては、注射剤からボリコナゾールの投与を開始し、患者の状態に応じて、経口投与可能であると医師が判断した場合に、錠剤、顆粒又はドライシロップに切り替えることができるが、投与開始から1週間未満で注射剤から経口剤に変更した際の有効性及び安全性は検討されていないため慎重に判断すること。なお、ボリコナゾール注射剤では食道カンジダ症の適応はないため、小児の食道カンジダ症に対する本剤の使用は推奨されない〔16.1.2参照〕。
7.3. 〈効能共通〉腎機能障害のある患者で注射剤の投与ができない成人患者に対しては、錠剤、顆粒又はドライシロップを使用すること。
7.4. 〈効能共通〉軽度~中等度肝機能低下(Child Pugh分類クラスA・Bの肝硬変に相当)がある患者では投与初日は通常の初日投与量とし、2日目以降は通常の2日目以降投与量の半量とすること〔9.3.2、15.1.1、16.6.1参照〕。
7.5. 〈造血幹細胞移植患者における深在性真菌症の予防〉好中球数が500/mm3以上に回復する、又は免疫抑制剤の投与終了など、適切な時期に投与を終了すること(臨床試験において、180日を超えた投与の有効性及び安全性は検討されていない)。
外形画像



改訂情報
2025年11月5日 DSU No.340 【その他】
【2.禁忌】(一部改訂)
次の薬剤を投与中の患者:リファンピシン、リファブチン、エファビレンツ、リトナビル、ロピナビル・リトナビル、ニルマトレルビル・リトナビル、カルバマゼピン、バルビタール、フェノバルビタール、ピモジド、キニジン、イバブラジン、麦角アルカロイド(エルゴタミン・無水カフェイン・イソプロピルアンチピリン、ジヒドロエルゴタミン、エルゴメトリン、メチルエルゴメトリン)、トリアゾラム、チカグレロル、アスナプレビル、ロミタピド、ブロナンセリン、スボレキサント、リバーロキサバン、アゼルニジピン、オルメサルタンメドキソミル・アゼルニジピン、ベネトクラクス(再発又は難治性の慢性リンパ性白血病(小リンパ球性リンパ腫を含む)の用量漸増期)、アナモレリン、ルラシドン、イサブコナゾニウム、フィネレノン、エプレレノン、ボクロスポリン、マバカムテン
【10.1併用禁忌】(追記)
2025年6月3日 DSU No.336 【重要】
【2.禁忌】(一部改訂)
次の薬剤を投与中の患者:リファンピシン、リファブチン、エファビレンツ、リトナビル、ロピナビル・リトナビル、ニルマトレルビル・リトナビル、カルバマゼピン、バルビタール、フェノバルビタール、ピモジド、キニジン、イバブラジン、麦角アルカロイド(エルゴタミン・無水カフェイン・イソプロピルアンチピリン、ジヒドロエルゴタミン、エルゴメトリン、メチルエルゴメトリン)、トリアゾラム、チカグレロル、アスナプレビル、ロミタピド、ブロナンセリン、スボレキサント、リバーロキサバン、アゼルニジピン、オルメサルタンメドキソミル・アゼルニジピン、ベネトクラクス(再発又は難治性の慢性リンパ性白血病(小リンパ球性リンパ腫を含む)の用量漸増期)、アナモレリン、ルラシドン、イサブコナゾニウム、フィネレノン、エプレレノン
【10.1併用禁忌】(削除)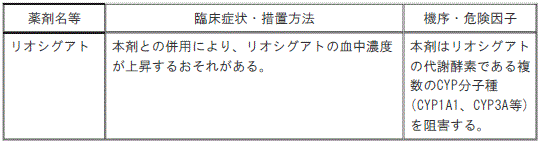
【10.1併用禁忌】(追記)
【10.2併用注意】(追記)
2025年6月3日 DSU No.336 【その他】
【2.禁忌】(一部改訂)
次の薬剤を投与中の患者:リファンピシン、リファブチン、エファビレンツ、リトナビル、ロピナビル・リトナビル、ニルマトレルビル・リトナビル、カルバマゼピン、バルビタール、フェノバルビタール、ピモジド、キニジン、イバブラジン、麦角アルカロイド(エルゴタミン・無水カフェイン・イソプロピルアンチピリン、ジヒドロエルゴタミン、エルゴメトリン、メチルエルゴメトリン)、トリアゾラム、チカグレロル、アスナプレビル、ロミタピド、ブロナンセリン、スボレキサント、リバーロキサバン、アゼルニジピン、オルメサルタンメドキソミル・アゼルニジピン、ベネトクラクス(再発又は難治性の慢性リンパ性白血病(小リンパ球性リンパ腫を含む)の用量漸増期)、アナモレリン、ルラシドン、イサブコナゾニウム、フィネレノン、エプレレノン、ボクロスポリン
【10.1併用禁忌】(追記)
2025年6月3日 DSU No.336 【その他】
【7.用法及び用量に関連する注意】(一部改訂)
〈効能共通〉
注射剤からボリコナゾールの投与を開始した成人患者において、経口投与可能であると医師が判断した場合は、錠剤、顆粒又はドライシロップに切り替えることができる。
【7.用法及び用量に関連する注意】(一部改訂)
小児においては、注射剤からボリコナゾールの投与を開始すること。患者の状態に応じて、経口投与可能であると医師が判断した場合に、錠剤、顆粒又はドライシロップに切り替えることができるが、投与開始から1週間未満で注射剤から経口剤に変更した際の有効性及び安全性は検討されていないため慎重に判断すること。なお、ボリコナゾール注射剤では食道カンジダ症の適応はないため、小児の食道カンジダ症に対する本剤の使用は推奨されない。
【7.用法及び用量に関連する注意】(一部改訂)
腎機能障害のある患者で注射剤の投与ができない成人患者に対しては、錠剤、顆粒又はドライシロップを使用すること。
2025年5月20日 使用上の注意改訂情報 令和7年5月20日指示分
【2. 禁忌(次の患者には投与しないこと)】(一部改訂)
次の薬剤を投与中の患者:リファンピシン、リファブチン、エファビレンツ、リトナビル、ロピナビル・リトナビル、ニルマトレルビル・リトナビル、カルバマゼピン、バルビタール、フェノバルビタール、ピモジド、キニジン、イバブラジン、麦角アルカロイド(エルゴタミン・無水カフェイン・イソプロピルアンチピリン、ジヒドロエルゴタミン、エルゴメトリン、メチルエルゴメトリン)、トリアゾラム、チカグレロル、アスナプレビル、ロミタピド、ブロナンセリン、スボレキサント、リバーロキサバン、アゼルニジピン、オルメサルタン メドキソミル・アゼルニジピン、ベネトクラクス(再発又は難治性の慢性リンパ性白血病(小リンパ球性リンパ腫を含む)の用量漸増期)、アナモレリン、ルラシドン、イサブコナゾニウム、フィネレノン、エプレレノン
【10. 相互作用-10.1 併用禁忌(併用しないこと)】(削除)
【10. 相互作用-10.1 併用禁忌(併用しないこと)】(新設)
【10. 相互作用-10.2 併用注意(併用に注意すること)】(新設)
医師の処方により使用する医薬品。



 で医薬品を比較する
で医薬品を比較する
