リツキサン点滴静注500mg
医療用
医療用医薬品:
医師の処方により使用する医薬品
医師の処方により使用する医薬品
- 収載区分
- 銘柄別収載
- 先発・後発情報
- 先発品(後発品あり)
- オーソライズド
ジェネリック - -
- 一般名
- リツキシマブ(遺伝子組換え)注射液
- 英名(商品名)
- Rituxan
- 規格
- 500mg50mL1瓶
- 薬価
- 94,007.00
- メーカー名
- 全薬/中外製薬/全薬販売
- 規制区分
- -
- 長期投与制限
- -
- 標榜薬効
- 抗悪性腫瘍薬〔抗CD20モノクローナル抗体〕
- 色
- -
- 識別コード
- -
- [@: メーカーロゴ]
- 添付文書
-
PDF 2024年11月改訂(第12版)
- 告示日
- 2018年6月14日
- 経過措置期限
- -
- 医薬品マスタに反映
- 2018年7月版
- 医薬品マスタ削除予定
- -
- 運転注意
- 情報なし(使用の適否を判断するものではありません)
- ドーピング
- 禁止物質なし(使用の適否を判断するものではありません)
- CP換算
- -
- 長期収載品選定療養
- -
[識別コードの表記 @: メーカーロゴ]
効能効果
1). CD20陽性B細胞性非ホジキンリンパ腫。
2). CD20陽性慢性リンパ性白血病。
3). 免疫抑制状態下のCD20陽性B細胞性リンパ増殖性疾患。
4). 多発血管炎性肉芽腫症、顕微鏡的多発血管炎。
5). 既存治療で効果不十分なループス腎炎。
6). 難治性ネフローゼ症候群<頻回再発型>、難治性ネフローゼ症候群<ステロイド依存性を示す場合>あるいは難治性ネフローゼ症候群<ステロイド抵抗性を示す場合>。
7). 慢性特発性血小板減少性紫斑病。
8). 後天性血栓性血小板減少性紫斑病。
9). 全身性強皮症。
10). 難治性尋常性天疱瘡及び難治性落葉状天疱瘡。
11). 視神経脊髄炎スペクトラム障害(視神経脊髄炎を含む)の再発予防。
12). 次記の臓器移植における抗体関連型拒絶反応の抑制:腎移植、肝移植、心移植、肺移植、膵移植、小腸移植。
13). 次記の臓器移植における抗体関連型拒絶反応の治療:腎移植、肝移植、心移植、肺移植、膵移植、小腸移植。
14). インジウム<111In>イブリツモマブ チウキセタン<遺伝子組換え>注射液及びイットリウム<90Y>イブリツモマブ チウキセタン<遺伝子組換え>注射液投与の前投与。
(効能又は効果に関連する注意)
5.1. 〈B細胞性非ホジキンリンパ腫、慢性リンパ性白血病、免疫抑制状態下のB細胞性リンパ増殖性疾患〉本剤投与の適応となる造血器腫瘍の診断は、病理診断に十分な経験を持つ医師又は施設により行うこと。
5.2. 〈B細胞性非ホジキンリンパ腫、慢性リンパ性白血病、免疫抑制状態下のB細胞性リンパ増殖性疾患〉免疫組織染色法又はフローサイトメトリー法等によりCD20抗原の検査を行い、陽性であることが確認されている患者のみに投与すること。
5.3. 〈多発血管炎性肉芽腫症、顕微鏡的多発血管炎〉初発例を含む疾患活動性が高い患者、既存治療で十分な効果が得られない患者等に対して本剤の投与を考慮すること。
5.4. 〈既存治療で効果不十分なループス腎炎〉既存治療(ステロイド、免疫抑制剤等)で十分な効果が得られない患者に対して本剤の投与を考慮し、また、診療ガイドライン等の最新の情報を参考に、本剤の投与が適切と判断される患者に使用すること。
5.5. 〈難治性ネフローゼ症候群〉小児期に特発性ネフローゼ症候群を発症した次の患者に限ること[1)頻回再発型或いはステロイド依存性を示し既存治療(ステロイド、免疫抑制剤等)で寛解が維持できない患者、2)ステロイド抵抗性を示し既存治療(ステロイド、免疫抑制剤等)で寛解が得られない患者]〔17.1.5、17.1.6参照〕。
5.6. 〈難治性ネフローゼ症候群〉診療ガイドライン等の最新の情報を参考に、本剤の投与が適切と判断される患者に使用すること。なお、成人期に発症したネフローゼ症候群の患者に対する有効性及び安全性は確立していない。
5.7. 〈慢性特発性血小板減少性紫斑病〉他の治療にて十分な効果が得られない場合、又は忍容性に問題があると考えられる場合にのみ使用を考慮し、血小板数、臨床症状からみて出血リスクが高いと考えられる患者に使用し、また、診療ガイドライン等の最新の情報を参考に、本剤の投与が適切と判断される患者に使用すること。
5.8. 〈後天性血栓性血小板減少性紫斑病〉再発又は難治の場合にのみ使用を考慮し、また、診療ガイドライン等の最新の情報を参考に、本剤の投与が適切と判断される患者に使用すること。
5.9. 〈全身性強皮症〉「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、診療ガイドライン等の最新の情報を参考に、本剤の投与が適切と判断される患者に使用すること。
5.10. 〈全身性強皮症〉皮膚硬化以外の全身性強皮症に伴う病変に対する有効性及び安全性は十分に検討されていないため、これらの患者に投与する場合には、リスクとベネフィットを十分考慮すること。
5.11. 〈難治性尋常性天疱瘡及び落葉状天疱瘡〉経口ステロイド剤等の既存治療で十分な効果が得られない又は再燃のため経口ステロイド剤の減量が困難な患者に対して本剤の投与を考慮し、また、「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、本剤の投与が適切と判断される患者に使用すること。
5.12. 〈視神経脊髄炎スペクトラム障害の再発予防〉本剤は、視神経脊髄炎スペクトラム障害(視神経脊髄炎を含む)(「多発性硬化症・視神経脊髄炎スペクトラム障害診療ガイドライン2023」(日本神経学会)を参考にすること)の患者に使用すること。
5.13. 〈視神経脊髄炎スペクトラム障害の再発予防〉本剤は、抗アクアポリン4抗体陽性の患者に投与すること。
5.14. 〈臓器移植時の抗体関連型拒絶反応の抑制及び治療〉「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、診療ガイドライン等の最新の情報を参考に、本剤の投与が適切と判断される患者に使用すること。
用法用量
〈B細胞性非ホジキンリンパ腫〉
通常、成人には、リツキシマブ(遺伝子組換え)として1回量375mg/㎡を1週間間隔で点滴静注する。最大投与回数は8回とする。他の抗悪性腫瘍剤と併用する場合は、併用する抗悪性腫瘍剤の投与間隔に合わせて、1サイクルあたり1回投与する。維持療法に用いる場合は、通常、成人には、リツキシマブ(遺伝子組換え)として1回量375mg/㎡を点滴静注する。投与間隔は8週間を目安とし、最大投与回数は12回とする。
〈慢性リンパ性白血病〉
他の抗悪性腫瘍剤との併用において、通常、成人には、リツキシマブ(遺伝子組換え)として初回に1回量375mg/㎡、2回目以降は1回量500mg/㎡を、併用する抗悪性腫瘍剤の投与サイクルに合わせて、1サイクルあたり1回点滴静注する。最大投与回数は6回とする。
〈免疫抑制状態下のB細胞性リンパ増殖性疾患〉
通常、リツキシマブ(遺伝子組換え)として1回量375mg/㎡を1週間間隔で点滴静注する。最大投与回数は8回とする。
〈多発血管炎性肉芽腫症、顕微鏡的多発血管炎、後天性血栓性血小板減少性紫斑病、全身性強皮症〉
通常、成人には、リツキシマブ(遺伝子組換え)として1回量375mg/㎡を1週間間隔で4回点滴静注する。
〈既存治療で効果不十分なループス腎炎、慢性特発性血小板減少性紫斑病〉
通常、リツキシマブ(遺伝子組換え)として1回量375mg/㎡を1週間間隔で4回点滴静注する。
〈難治性のネフローゼ症候群〉
通常、リツキシマブ(遺伝子組換え)として1回量375mg/㎡を1週間間隔で4回点滴静注する。ただし、1回あたりの最大投与量は500mgまでとする。
〈難治性の尋常性天疱瘡及び落葉状天疱瘡〉
通常、成人には、リツキシマブ(遺伝子組換え)として1回量1000mg/bodyを2週間間隔で2回点滴静注する。
〈視神経脊髄炎スペクトラム障害の再発予防〉
通常、成人には、リツキシマブ(遺伝子組換え)として1回量375mg/㎡を1週間間隔で4回点滴静注する。その後、初回投与から6ヵ月毎に1回量1000mg/body(固定用量)を2週間間隔で2回点滴静注する。
〈臓器移植時の抗体関連型拒絶反応の抑制及び治療〉
通常、リツキシマブ(遺伝子組換え)として1回量375mg/㎡を点滴静注する。ただし、患者の状態により適宜減量する。
〈イブリツモマブ チウキセタンの前投与〉
通常、成人には、リツキシマブ(遺伝子組換え)として250mg/㎡を1回、点滴静注する。
〈効能共通〉
本剤は用時生理食塩液又は5%ブドウ糖注射液にて1~4mg/mLに希釈調製し使用する。
(用法及び用量に関連する注意)
7.1. 〈効能共通〉本剤投与時に頻発してあらわれるinfusion reactionを軽減させるために、本剤投与の30分前に抗ヒスタミン剤、解熱鎮痛剤等の前投与を行い、また、副腎皮質ホルモン剤と併用しない場合は、本剤の投与に際して、副腎皮質ホルモン剤の前投与を考慮すること〔1.2、7.8、11.1.1参照〕。
7.2. 〈効能共通〉注入速度に関連して血圧下降、気管支痙攣、血管浮腫等の症状が発現するので本剤の注入速度を守り、注入速度を上げる際は特に注意し、症状が発現した場合は注入速度を緩めるかもしくは中止し、重篤な症状の場合は直ちに投与を中止し、適切な処置を行う(また、投与を再開する場合は症状が完全に消失した後、中止時点の半分以下の注入速度で投与を開始する)〔1.2、11.1.1参照〕。
7.3. 〈効能共通〉注入速度は次のとおりとする。ただし、患者の状態により注入開始速度は適宜減速すること。
1). B細胞性非ホジキンリンパ腫:初回投与;最初の30分は50mg/時で開始し、患者の状態を十分観察しながら、その後30分毎に50mg/時ずつ上げて、最大400mg/時まで上げることができる(患者の状態により注入開始速度は適宜減速すること)。
2). B細胞性非ホジキンリンパ腫:2回目以降;次記のいずれかに該当する場合は、当該注入速度を選択することができる[①2回目以降;初回投与時に発現した副作用が軽微であった場合、100mg/時まで上げて投与を開始し、その後30分毎に100mg/時ずつ上げて、最大400mg/時まで上げることができる(患者の状態により注入開始速度は適宜減速すること)、②2回目以降;臨床的に重篤な心疾患がなく初回時に発現した副作用が軽微かつ投与前の末梢血リンパ球数5000/μL未満の場合、90分間で投与(最初の30分で投与量の20%を投与後、60分で投与量の80%を投与)できる(患者状態により注入開始速度は適宜減速)]。
3). 慢性リンパ性白血病、免疫抑制状態下のB細胞性リンパ増殖性疾患、多発血管炎性肉芽腫症、顕微鏡的多発血管炎、既存治療で効果不十分なループス腎炎、難治性ネフローゼ症候群、慢性特発性血小板減少性紫斑病、後天性血栓性血小板減少性紫斑病、全身性強皮症、難治性尋常性天疱瘡及び落葉状天疱瘡、イブリツモマブ チウキセタンの前投与:初回投与;最初の30分は50mg/時で開始し、患者の状態を十分観察しながら、その後30分毎に50mg/時ずつ上げて、最大400mg/時まで上げることができる(患者の状態により注入開始速度は適宜減速すること)。
4). 慢性リンパ性白血病、免疫抑制状態下のB細胞性リンパ増殖性疾患、多発血管炎性肉芽腫症、顕微鏡的多発血管炎、既存治療で効果不十分なループス腎炎、難治性ネフローゼ症候群、慢性特発性血小板減少性紫斑病、後天性血栓性血小板減少性紫斑病、全身性強皮症、難治性尋常性天疱瘡及び落葉状天疱瘡、イブリツモマブ チウキセタンの前投与:2回目以降;初回投与時に発現した副作用が軽微であった場合、100mg/時まで上げて投与を開始し、その後30分毎に100mg/時ずつ上げて、最大400mg/時まで上げることができる(患者の状態により注入開始速度は適宜減速すること)。
5). 視神経脊髄炎スペクトラム障害の再発予防:初回投与;最初の30分は50mg/時で開始し、患者の状態を十分観察しながら、その後30分毎に50mg/時ずつ上げて、最大400mg/時まで上げることができる(患者の状態により注入開始速度は適宜減速すること)。
6). 視神経脊髄炎スペクトラム障害の再発予防:2回目以降;初回投与時に発現した副作用が軽微であった場合、100mg/時まで上げて投与を開始し、その後30分毎に100mg/時ずつ上げて、最大400mg/時まで上げることができる(患者の状態により注入開始速度は適宜減速すること)、なお、初回投与から6ヵ月目以降の投与の場合、6ヵ月毎に1回目の投与は「初回投与」の注入速度に従って投与すること。
7). 臓器移植時の抗体関連型拒絶反応の抑制及び治療:初回投与;最初の1時間は25mg/時とし、患者の状態を十分に観察しながら、次の1時間は100mg/時、その後は最大200mg/時までを目安とすること(患者の状態により注入開始速度は適宜減速すること)。
8). 臓器移植時の抗体関連型拒絶反応の抑制及び治療:2回目以降;初回投与時に発現した副作用が軽微であった場合、100mg/時まで上げて投与を開始できる(患者の状態により注入開始速度は適宜減速すること)。
7.4. 〈免疫抑制状態下のB細胞性リンパ増殖性疾患、多発血管炎性肉芽腫症、顕微鏡的多発血管炎、既存治療で効果不十分なループス腎炎、難治性ネフローゼ症候群、慢性特発性血小板減少性紫斑病、後天性血栓性血小板減少性紫斑病、全身性強皮症、難治性尋常性天疱瘡及び落葉状天疱瘡〉再投与時の有効性及び安全性に関する情報は限られているため、本剤の再投与に関しては、実施の可否を慎重に検討すること。
7.5. 〈B細胞性非ホジキンリンパ腫〉維持療法に用いる場合は、臨床試験に組み入れられた患者の組織型等について、「17.臨床成績」の項の内容を熟知し、国内外の最新のガイドライン等を参考に本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと〔17.1.2参照〕。
7.6. 〈B細胞性非ホジキンリンパ腫〉中悪性度リンパ腫・高悪性度リンパ腫に対する本剤の維持療法の有効性及び安全性は確立していない。
7.7. 〈B細胞性非ホジキンリンパ腫〉他の抗悪性腫瘍剤と併用する場合は、臨床試験において検討された本剤の投与間隔、投与時期等について、「17.臨床成績」の項の内容を熟知し、国内外の最新のガイドライン等を参考にすること〔17.1.2参照〕。
7.8. 〈B細胞性非ホジキンリンパ腫〉本剤投与時に頻発してあらわれるinfusion reactionを軽減させるために、本剤を90分間で投与するに際し、併用する化学療法に副腎皮質ホルモン剤が含まれる場合には、当該副腎皮質ホルモン剤の前投与を行うこと〔1.2、7.1、11.1.1参照〕。
7.9. 〈既存治療で効果不十分なループス腎炎〉原則として副腎皮質ステロイド剤を併用すること。
7.10. 〈難治性のネフローゼ症候群〉ステロイド抵抗性を示す難治性ネフローゼ症候群患者に投与する場合は、原則としてステロイド剤(パルス療法)を併用すること(さらに、免疫抑制剤を併用することが望ましい)〔17.1.6参照〕。
7.11. 〈視神経脊髄炎スペクトラム障害の再発予防〉本剤の血中濃度低下により再発のおそれがあるため、投与間隔を遵守すること。
7.12. 〈視神経脊髄炎スペクトラム障害の再発予防〉本剤による一定期間の治療の後、再発の頻度について検討し、再発の頻度の減少が認められない等、本剤のベネフィットが期待されないと考えられる患者では、本剤による治療の中止を検討すること。
7.13. 〈臓器移植時の抗体関連型拒絶反応の抑制〉本剤の投与量及び投与回数は、患者の状態に応じ、適宜調節すること。投与時期については、次記を目安とする。
・ 腎移植時の抗体関連型拒絶反応の抑制の場合は、移植術2週間以上前及び1日前に2回点滴静注する。
・ 肝移植・心移植・肺移植・膵移植及び小腸移植時の抗体関連型拒絶反応の抑制の場合は、移植術2週間以上前に1回点滴静注し、1回投与で抗体価の減少が不十分又はB細胞数の減少が不十分な場合には、さらに1回追加投与する。
7.14. 〈臓器移植時の抗体関連型拒絶反応の治療〉本剤の投与量及び投与回数は、患者の状態に応じ、適宜調節すること。投与回数については、次記を目安とする。
・ 〈臓器移植時の抗体関連型拒絶反応の治療〉1回点滴静注し、1回投与で抗体価の減少が不十分又はB細胞数の減少が不十分な場合には、さらに1回追加投与する。
改訂情報
2025年1月6日 DSU No.332 【その他】
【6.用法及び用量】(一部改訂)
〈既存治療で効果不十分なループス腎炎、慢性特発性血小板減少性紫斑病〉
通常、リツキシマブ(遺伝子組換え)として1回量375mg/㎡を1週間間隔で4回点滴静注する。
【9.4生殖能を有する者】(新設)
妊娠する可能性のある女性には、本剤投与中及び最終投与後12ヵ月間において避妊する必要性及び適切な避妊法について説明すること。
【9.7小児等】(一部改訂)
〈免疫抑制状態下のB細胞性リンパ増殖性疾患、既存治療で効果不十分なループス腎炎、難治性のネフローゼ症候群、慢性特発性血小板減少性紫斑病、臓器移植時の抗体関連型拒絶反応の抑制及び治療〉
低出生体重児、新生児、乳児を対象とした臨床試験は実施していない。
2024年11月27日 DSU No.331 【その他】
【5.効能又は効果に関連する注意】(一部改訂)
〈難治性のネフローゼ症候群〉
小児期に特発性ネフローゼ症候群を発症した以下の患者に限ること。
・頻回再発型あるいはステロイド依存性を示し、既存治療(ステロイド、免疫抑制剤等)では寛解が維持できない患者
・ステロイド抵抗性を示し、既存治療(ステロイド、免疫抑制剤等)では寛解が得られない患者
【7.用法及び用量に関連する注意】(一部改訂)
〈効能共通〉
注入速度は以下のとおりとする。ただし、患者の状態により注入開始速度は適宜減速すること。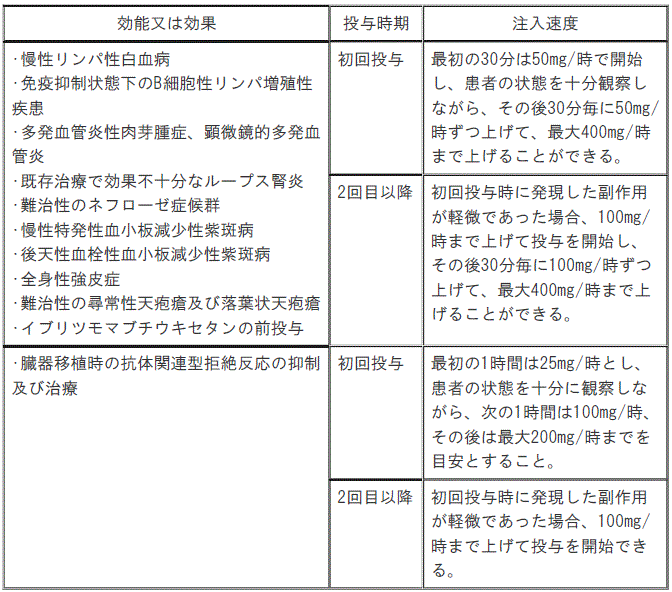
【7.用法及び用量に関連する注意】(追記)
〈難治性のネフローゼ症候群〉
ステロイド抵抗性を示す患者に投与する場合は、原則としてステロイド剤(パルス療法)を併用すること。さらに、免疫抑制剤を併用することが望ましい。
【9.7小児等】(一部改訂)
〈免疫抑制状態下のB細胞性リンパ増殖性疾患、既存治療で効果不十分なループス腎炎、難治性のネフローゼ症候群、臓器移植時の抗体関連型拒絶反応の抑制及び治療〉
低出生体重児、新生児、乳児を対象とした臨床試験は実施していない。
【9.7小児等】(削除)
〈難治性のネフローゼ症候群〉
低出生体重児、新生児、乳児及び3歳未満の幼児を対象とした臨床試験は実施していない。
【15.1臨床使用に基づく情報】(一部改訂)
〈効能共通〉
難治性のネフローゼ症候群患者における成績:
国内臨床試験において測定された60例中、本剤に対するヒト抗キメラ抗体は11例に検出された。
2024年3月1日 DSU No.324 【その他】
【5.効能又は効果に関連する注意】(追記)
【新様式】
〈臓器移植時の抗体関連型拒絶反応の抑制及び治療〉
「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、診療ガイドライン等の最新の情報を参考に、本剤の投与が適切と判断される患者に使用すること。
【6.用法及び用量】(一部改訂)
【新様式】
〈臓器移植時の抗体関連型拒絶反応の抑制及び治療〉
通常、リツキシマブ(遺伝子組換え)として1回量375mg/㎡を点滴静注する。ただし、患者の状態により適宜減量する。
【7.用法及び用量に関連する注意】(一部改訂)
【新様式】
〈効能共通〉
注入速度は以下のとおりとする。ただし、患者の状態により注入開始速度は適宜減速すること。
【7.用法及び用量に関連する注意】(一部改訂)
【新様式】
〈臓器移植時の抗体関連型拒絶反応の抑制〉
本剤の投与量及び投与回数は、患者の状態に応じ、適宜調節すること。投与時期については、下記を目安とする。
・腎移植の場合は、移植術2週間以上前及び1日前に2回点滴静注する。
・肝移植、心移植、肺移植、膵移植及び小腸移植の場合は、移植術2週間以上前に1回点滴静注する。1回投与で抗体価又はB細胞数の減少が不十分な場合には、さらに1回追加投与する。
【7.用法及び用量に関連する注意】(追記)
【新様式】
本剤の投与量及び投与回数は、患者の状態に応じ、適宜調節すること。投与回数については、下記を目安とする。
・1回点滴静注する。1回投与で抗体価又はB細胞数の減少が不十分な場合には、さらに1回追加投与する。
【9.7小児等】(一部改訂)
【新様式】
〈免疫抑制状態下のB細胞性リンパ増殖性疾患、既存治療で効果不十分なループス腎炎、臓器移植時の抗体関連型拒絶反応の抑制及び治療〉
低出生体重児、新生児、乳児を対象とした臨床試験は実施していない。
【15.その他の注意】(追記)
【新様式】
〈効能共通〉
腎移植患者に対する抗体関連型拒絶反応の抑制における成績:
国内臨床試験において測定された24例中、本剤に対するヒト抗キメラ抗体は検出されなかった。
医師の処方により使用する医薬品。
特定薬剤管理指導加算等の算定対象となる薬剤。



 で医薬品を比較する
で医薬品を比較する
