シクロスポリンカプセル25mg「TC」
医療用
医療用医薬品:
医師の処方により使用する医薬品
医師の処方により使用する医薬品
- 収載区分
- 統一名収載
- 先発・後発情報
- 後発品(加算対象)
- オーソライズド
ジェネリック - -
- 一般名
- シクロスポリン25mgカプセル
- 英名(商品名)
- Ciclosporin TC
- 規格
- 25mg1カプセル
- 薬価
- 50.20
- メーカー名
- 東洋カプセル/沢井製薬
- 規制区分
- 劇薬
- 長期投与制限
- -
- 標榜薬効
- 免疫抑制薬〔カルシニューリン阻害薬〕
- 色
- 白〜淡黄白
- 識別コード
- (被包)@33 25mg (被包)TC33 25mg
- [@: メーカーロゴ]
- 添付文書
-
PDF 2024年6月改訂(第2版)
- 告示日
- 2014年12月11日
- 経過措置期限
- -
- 医薬品マスタに反映
- 2015年1月版
- DIRに反映
- 2015年1月版
- DIR削除予定
- -
- 運転注意
- 情報なし(使用の適否を判断するものではありません)
- ドーピング
- 禁止物質なし(使用の適否を判断するものではありません)
- CP換算
- -
- 長期収載品選定療養
- -
[識別コードの表記 @: メーカーロゴ]
効能効果
1). 次記の臓器移植における拒絶反応の抑制:腎移植、肝移植、心移植、肺移植、膵移植、小腸移植。
2). 骨髄移植における拒絶反応及び移植片対宿主病の抑制。
3). ベーチェット病<眼症状のある場合>、及びその他の非感染性ぶどう膜炎(既存治療で効果不十分であり、視力低下のおそれのある活動性中間部非感染性ぶどう膜炎又は活動性後部非感染性ぶどう膜炎に限る)。
4). 尋常性乾癬<皮疹が全身の30%以上に及ぶもの>あるいは尋常性乾癬<難治性>の場合、膿疱性乾癬、乾癬性紅皮症、乾癬性関節炎。
5). 再生不良性貧血、赤芽球癆。
6). ネフローゼ症候群<頻回再発型>あるいはネフローゼ症候群<ステロイドに抵抗性を示す場合>。
7). 全身型重症筋無力症:胸腺摘出後の治療において、ステロイド剤の投与が効果不十分、又は副作用により困難な場合。
8). アトピー性皮膚炎(既存治療で十分な効果が得られない患者)。
9). 細胞移植に伴う免疫反応の抑制。
(効能又は効果に関連する注意)
5.1. 〈再生不良性貧血〉診療ガイドライン等の最新の情報を参考に、本剤の投与が適切と判断される患者に投与すること(また、寛解例で本剤投与中止後に再燃したため再投与する場合の有効性及び安全性については、十分な評価が確立していないので、患者の状態をみながら治療上の有益性が優先すると判断される場合にのみ投与すること)。
5.2. 〈ネフローゼ症候群〉副腎皮質ホルモン剤に反応はするものの頻回に再発を繰り返す患者、又は副腎皮質ホルモン剤治療に抵抗性を示す患者に限ること。
5.3. 〈全身型重症筋無力症〉本剤を単独で投与した際の有効性については使用経験がなく明らかでない。
5.4. 〈アトピー性皮膚炎〉ステロイド外用剤やタクロリムス外用剤等の既存治療で十分な効果が得られず、強い炎症を伴う皮疹が体表面積の30%以上に及ぶ患者を対象にすること。
用法用量
〈腎移植〉
通常、移植1日前からシクロスポリンとして1日量9~12mg/kgを1日2回に分けて経口投与し、以後1日2mg/kgずつ減量する。維持量は1日量4~6mg/kgを標準とするが、症状により適宜増減する。
〈肝移植〉
通常、移植1日前からシクロスポリンとして1日量14~16mg/kgを1日2回に分けて経口投与する。以後徐々に減量し、維持量は1日量5~10mg/kgを標準とするが、症状により適宜増減する。
〈心移植、肺移植、膵移植〉
通常、移植1日前からシクロスポリンとして1日量10~15mg/kgを1日2回に分けて経口投与する。以後徐々に減量し、維持量は1日量2~6mg/kgを標準とするが、症状により適宜増減する。
〈小腸移植〉
通常、シクロスポリンとして1日量14~16mg/kgを1日2回に分けて経口投与する。以後徐々に減量し、維持量は1日量5~10mg/kgを標準とするが、症状により適宜増減する。ただし、通常移植1日前からシクロスポリン注射剤で投与を開始し、内服可能となった後はできるだけ速やかに経口投与に切り換える。
〈骨髄移植〉
通常、移植1日前からシクロスポリンとして1日量6~12mg/kgを1日2回に分けて経口投与し、3~6ヵ月間継続し、その後徐々に減量し中止する。
〈ベーチェット病及びその他の非感染性ぶどう膜炎〉
通常、シクロスポリンとして1日量5mg/kgを1日2回に分けて経口投与を開始し、以後1ヵ月毎に1日1~2mg/kgずつ減量又は増量する。維持量は1日量3~5mg/kgを標準とするが、症状により適宜増減する。
〈乾癬〉
通常、1日量5mg/kgを2回に分けて経口投与する。効果がみられた場合は1ヵ月毎に1日1mg/kgずつ減量し、維持量は1日量3mg/kgを標準とする。なお、症状により適宜増減する。
〈再生不良性貧血〉
通常、シクロスポリンとして1日量6mg/kgを1日2回に分けて経口投与する。なお、患者の状態により適宜増減する。
〈ネフローゼ症候群〉
通常、シクロスポリンとして次記の用量を1日2回に分けて経口投与する。なお、症状により適宜増減する。
(1). 頻回再発型の症例
成人には1日量1.5mg/kgを投与する。また、小児の場合には1日量2.5mg/kgを投与する。
(2). ステロイドに抵抗性を示す症例
成人には1日量3mg/kgを投与する。また、小児の場合には1日量5mg/kgを投与する。
〈全身型重症筋無力症〉
通常、シクロスポリンとして1日量5mg/kgを1日2回に分けて経口投与する。効果がみられた場合は徐々に減量し、維持量は3mg/kgを標準とする。なお、症状により適宜増減する。
〈アトピー性皮膚炎〉
通常、成人にはシクロスポリンとして1日量3mg/kgを1日2回に分けて経口投与する。なお、症状により適宜増減するが1日量5mg/kgを超えないこと。
〈細胞移植に伴う免疫反応の抑制〉
再生医療等製品の用法及び用量又は使用方法に基づき使用する。
(用法及び用量に関連する注意)
7.1. 〈効能共通〉サンディミュン(内用液又はカプセル)から本剤に切り換えて投与する場合は、原則として1:1の比(mg/kg/日)で切り換えて投与するが、シクロスポリンの血中濃度(AUC、Cmax)が上昇して副作用を発現するおそれがあるので、切り換え前後で血中濃度の測定及び臨床検査(血清クレアチニン、血圧等)を頻回に行うとともに患者の状態を十分観察し、必要に応じて投与量を調節すること。ただし、通常の開始用量(初めてサンディミュンを服用する時の投与量)より高い用量を服用している患者で、一時的に免疫抑制作用が不十分となっても病状が悪化して危険な状態に陥る可能性のない患者では、切り換え時の投与量は多くても通常の開始用量とし、血中濃度及び患者の状態に応じて投与量を調節すること〔1.3、16.1.1、16.1.2参照〕。
7.2. 〈効能共通〉本剤の投与にあたっては血中トラフ値(trough level)を測定し、投与量を調節すること〔8.1参照〕。
7.2.1. 臓器移植患者に投与する際には、過量投与による副作用の発現及び低用量投与による拒絶反応の発現等を防ぐため、血中濃度の測定を移植直後は頻回に行い、その後は1ヵ月に1回を目安に測定し、投与量を調節すること。
7.2.2. ベーチェット病及びその他の非感染性ぶどう膜炎、乾癬、再生不良性貧血、ネフローゼ症候群、全身型重症筋無力症、アトピー性皮膚炎患者に投与する際には、副作用の発現を防ぐため、1ヵ月に1回を目安に血中濃度を測定し、投与量を調節することが望ましい。
7.3. 〈臓器移植〉3剤あるいは4剤の免疫抑制剤を組み合わせた多剤免疫抑制療法を行う場合には、本剤の初期投与量を低く設定することが可能な場合もあるが、移植患者の状態及び併用される他の免疫抑制剤の種類・投与量等を考慮して投与量を調節すること。
7.4. 〈再生不良性貧血〉本剤の投与量及び投与期間について、診療ガイドライン等の最新の情報を参考とし、効果がみられない場合は他の適切な治療法を考慮すること。
7.5. 〈ネフローゼ症候群〉本剤の効果は、通常、1~3ヵ月であらわれるが、3ヵ月以上継続投与しても効果があらわれない場合には投与を中止することが望ましく、また、効果がみられた場合には、その効果が維持できる用量まで減量することが望ましい。
7.6. 〈ネフローゼ症候群〉本剤の使用前に副腎皮質ホルモン剤が維持投与されている場合は、その維持量に本剤を上乗せすること(症状により、副腎皮質ホルモン剤は適宜減量するが、増量を行う場合には本剤の使用は一旦中止すること)。
7.7. 〈アトピー性皮膚炎〉投与期間はできる限り短期間にとどめ、本剤の投与中は有効性及び安全性の評価を定期的に行い、8週間の投与でも改善がみられない場合には投与を中止すること(なお、1回の治療期間は12週間以内を目安とする)。
外形画像

改訂情報
2024年6月25日 DSU No.327 【その他】
【2.禁忌】(一部改訂)
タクロリムス(外用剤を除く)、ピタバスタチン、ロスバスタチン、ボセンタン、アリスキレン、グラゾプレビル、ペマフィブラートを投与中の患者
【10.相互作用】(一部改訂)
多くの薬剤との相互作用が報告されているが、可能性のあるすべての組み合わせについて検討されているわけではないので、他剤と併用したり、本剤又は併用薬を休薬する場合には注意すること。本剤は代謝酵素チトクロームP450 3A4(CYP3A4)で代謝され、また、CYP3A4及びP糖蛋白の阻害作用を有する。本剤はP糖蛋白の基質であるため、P糖蛋白阻害剤又は誘導剤により、本剤の血中濃度が変化する可能性がある。したがって、これらの酵素、輸送蛋白質に影響する医薬品・食品と併用する場合には、可能な限り薬物血中濃度を測定するなど用量に留意して慎重に投与すること。
【10.1併用禁忌】(削除)
【10.1併用禁忌】(削除)
バニプレビル
【10.1併用禁忌】(一部改訂)
【10.2併用注意】(削除)
ムロモナブCD3(OKT3)
キヌプリスチン・ダルホプリスチン、サキナビル、テラプレビル、シメプレビル
【10.2併用注意】(一部改訂)
【10.2併用注意】(削除)
【10.2併用注意】(追記)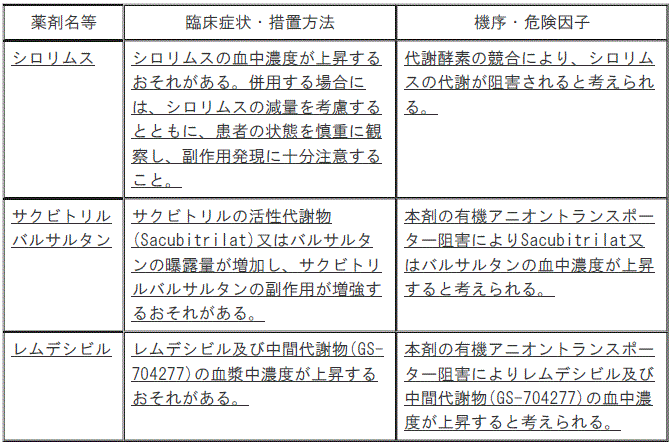
医師の処方により使用する医薬品。
特定薬剤管理指導加算等の算定対象となる薬剤。


