後発医薬品(ジェネリック医薬品)の添付文書情報について読み解きます。
後発医薬品の品質再評価
後発医薬品(ジェネリック医薬品)とは、先発医薬品(新薬)の特許が切れた後に販売される、先発医薬品と同じ有効成分、同じ効能・効果をもつ医薬品です。
しかし、医薬品業界では、以前から「“品質面”や“安定供給”において不安がある。」との意見があり、“品質面”では次のような点が問題視されていました。
(1)品質が申請されたときの状態で保たれているか。
(2)品質が保たれていることを確認する溶出試験が進んでいない。
(3)「生物学的同等性試験に関する試験基準」等の施行前に承認されたものが使用されている。
そこで、厚生労働省はこうした状況を改善すべく、後発医薬品の品質を確保するために、平成10年7月に品質再評価の実施手順などを通知し、公的溶出試験規格を設定し、その結果を公表することにしました。
公表の方法としては、日本薬局方外医薬品規格第3部に追加修正を行い、医療用医薬品品質情報集(日本版オレンジブック)を発行しています。
また、この情報は、医薬品医療機器総合機構が管理する医薬品医療機器情報提供ホームページ中の医療用医薬品品質情報集 品目リスト(品質再評価結果)(http://www.pmda.go.jp/review-services/reexamine-reevaluate/re-evaluations/0013.html)にも掲載され、品質再評価に指定された品目に関する品質再評価の状況や結果が、成分または商品毎に公開されています。
→ 後発薬に関するデータベースとして先発後発一般名処方DBや後発医薬品DBなどをご利用いただけます
品質評価に関する添付文書の記載
前述した後発医薬品に対して実施されている溶出試験には、次の2つがあります。
(1)溶出試験規格への適合性の確認
内用固形製剤の品質を一定に保つために、先発医薬品および後発医薬品の製造承認規格として「溶出試験規格」が設定されており、後発医薬品は、先発医薬品で設定されている「公的溶出規格」に対し適合性を確認します。
(2)先発品との溶出挙動の比較
先発医薬品との生物学的同等性を間接的に保証するために、指定された先発医薬品の標準製剤と溶出挙動における同等性を証明します。
品質再評価の適合には、(1)の「公的溶出規格」に合致し、かつ(1)の溶出挙動が標準製剤と同等であることが条件となります。
但し、溶出挙動が同等と判定されなくても、基準に従った生物学的同等性試験を行い、同等性を証明すれば良いとされています。
こうした生物学的同等性試験に関する情報や溶出試験に関する情報、および安定性試験に関する情報は、後発医薬品の添付文書【薬物動態】の項と【取り扱い上の注意】の項で確認することができます。以下に、その一例を示します。


各試験が終了した後発医薬品の添付文書には、上記のような情報が収載されていますので、後発医薬品を選択する際の目安として活用することができます。
続いて、品質や副作用に影響を及ぼすと考えられる「添加物」に関する情報と、「効能・効果」の情報について解説します。
添加物
後発医薬品(ジェネリック医薬品)の添加物は、必ずしも先発医薬品(新薬)の添加物と同じとは限りません。
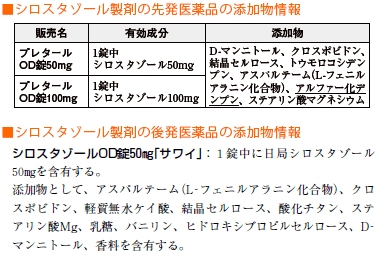
上記例示において、先発医薬品では<トウモロコシデンプン>が添加されているのに対し、後発医薬品では<乳糖>が添加されています。
この違いから、処方薬を先発医薬品から後発医薬品に切り替える際に、患者さんが乳糖不耐症か否かを必ず確認する必要があるという情報を導き出すことができます。
言い換えると、先発医薬品から後発医薬品に切り替える際は、添加物の情報も十分注意する必要があるということが言えます。
効能・効果
後発医薬品は、先発医薬品と同じ有効成分、同じ効能・効果をもつ医薬品であると定義されていますが、皆さんもご存知のとおり、同じ効能・効果を持つとは限りません。
次に示すプランルカスト水和物ドライシロップもその代表例のひとつです。

プランルカスト水和物ドライシロップの先発医薬品には<アレルギー性鼻炎>の適応がありますが、後発医薬品には、この適応がありません。
効能・効果にも特許があるので一概には言えませんが、この適応の違いに関する問題に対し、厚生労働省は「後発医薬品における効能効果等の是正について」という通知を出して、先発医薬品と後発医薬品の効能・効果等の相違を是正するための対応を行っています。
しかしながら、効能・効果違いは、患者さんの疾患によって保険査定の対象となるので十分注意をする必要があります。




